Une vague transitoire d’hématopoïèse périnatale chez les vertébrés
L'un des principaux défis de la médecine régénérative est de produire des cellules souches hématopoïétiques (CSH). Dans le cadre d'une collaboration avec l'Institut Ubrecht (Pays Bas) les chercheurs démontrent l'existence d'une nouvelle vague hématopoïétique à partir de cellules endothéliales hématogènes résidentes de la mœlle osseuse du fœtus tardif et du jeune adulte. Cette vague fait la jonction entre la fin de l'hématopoïèse embryonnaire et le début de l’hématopoïèse médullaire chez le poulet et la souris. Les résultats de cette étude sont publiés dans la revue Nature Cell Biology.
Les greffes de CSH sont la réponse thérapeutique aux traitements de certaines hémopathies malignes ainsi qu’aux soins radio ou chimiothérapiques nécessaires pour traiter les tumeurs solides. La production contrôlée de CSH à partir de précurseurs pluripotents reste très difficile à réaliser in vitro et nécessite donc une meilleure compréhension de la production de CSH durant le développement.
Les cellules souches hématopoïétiques (CSH) sont des cellules multipotentes qui résident dans la mœlle osseuse (MO) chez l’adulte et qui sont responsables de la production journalière de toutes les cellules hématopoïétiques.
L’embryon se développe en utilisant un ensemble de cellules hématopoïétiques issues d’une annexe embryonnaire, le sac vitellin, et cette production est nécessaire et suffisante pour assurer sa survie. Les premières CSH sont produites très tôt au cours du développement, en petit nombre à partir de cellules endothéliales spécialisées, qualifiées d’hématogènes (CEH), via une transition cellulaire, dite endothélio-hématopoïétique (TEH), qui se produit dans l’aorte de l’embryon. Ce petit pool de CSH est ensuite amplifié dans le foie fœtal avant d’aller coloniser, en fin de gestation, la moelle osseuse (MO) via un processus qui verra son plein fonctionnement quelques semaines après la naissance.
Pour savoir comment le fœtus et le jeune adulte comblent cette « dépression hématopoïétique », les chercheurs ont utilisé une combinaison d'approches d’embryologie expérimentale, génétiques, transcriptomiques et fonctionnelles en utilisant les modèles poulet et souris. A l’aide de microchirurgie, de marquages génétiques et d’imageries in vivo, ils ont identifié les somites comme sources du réseau vasculaire de la MO. De manière inattendue, ils ont constaté que certaines cellules endothéliales dérivées des somites portaient un potentiel hématogène, i.e. des cellules capables de produire des CSH et des progéniteurs hématopoïétiques multipotents chez le fœtus tardif / jeune adulte, via une TEH. Les cellules hématopoïétiques issues de cette TEH se caractérisent par une signature moléculaire spécifique proche des cellules endothéliales subissant une TEH et/ou des CSH récemment formées dans l'aorte embryonnaire. Elles présentent une expression proéminente de certains membres de la voie de signalisation Notch, de gènes spécifiques de l'endothélium et des facteurs de transcription impliqués dans la TEH.
Ces résultats démontrent donc l’existence d’une production hématopoïétique transitoire périnatale. Des CSH et des progéniteurs hématopoïétiques peuvent être générés de novo au cours des stades embryonnaires tardifs ou après la naissance, à partir de cellules endothéliales hématogènes d'origine somitique via une TEH similaire à celle qui se produit dans l’aorte de l'embryon. De plus cette vague hématopoïétique transitoire pourrait également contribuer à préparer les niches médullaires à accueillir les CSH amplifiées dans le foie fœtal.
L’identification de toutes les étapes de la genèse des cellules souches hématopoïétiques ainsi que des événements moléculaires la contrôlant présente un intérêt fondamental et pourrait ouvrir des pistes pour la thérapie de troubles hématopoïétiques.
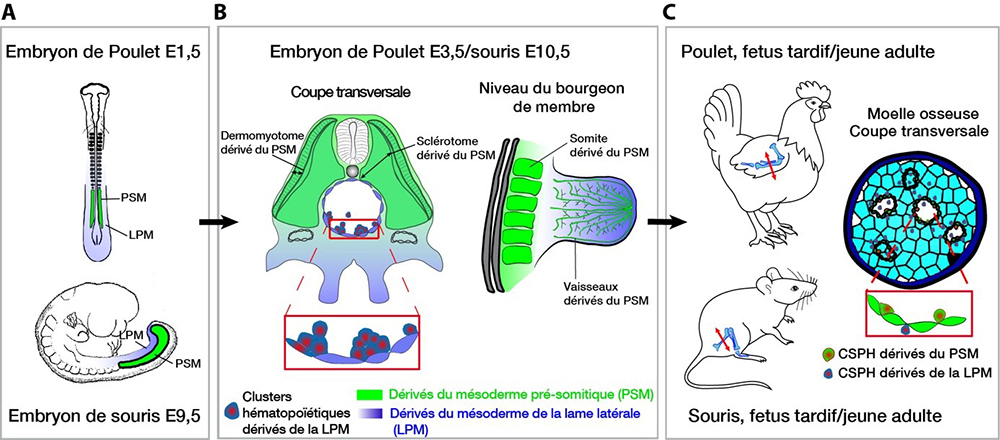
Figure : A-C: Localisation et devenir du mésoderme de la lame latérale (LPM, bleu) et du mésoderme pré-somitique (PSM, vert) à trois temps représentatifs et équivalents du développement du poulet et de la souris. A: PSM et LPM dans des embryons de souris de 1,5 et E9 jours embryonnaires (E). LPM : mésoderme situé latéralement et ventralement par rapport au PSM. B: le PSM se subdivise en somites, qui donnent naissance aux muscles, aux vaisseaux et aux vertèbres. Les CE hémogéniques de l'aorte et les clusters hématopoïétique associés proviennent exclusivement de la LPM. C: chez les jeunes adultes, les os et la moelle proviennent de la LPM, le système vasculaire du PSM. La plupart des cellules souches et progéniteurs hématopoïétiques (CSPH) présents dans la moelle osseuse proviennent de l’aorte. Nous montrons une production de novo par l'endothélium de la moelle osseuse dérivé du PSM.
Pour en savoir plus :
In vivo generation of haematopoietic stem/progenitor cells from bone marrow-derived haemogenic endothelium
Yvernogeau L, Gautier R, Petit L, Khoury H, Relaix F, Ribes V, Sang H, Charbord P, Michèle Souyri M, Robin C, Jaffredo T
Nature Cell Biology, 4 Nov 2019 https://doi.org/10.1038/s41556-019-0410-6