La résistance aux antibiotiques : une menace évitable ?
L’évolution des résistances aux traitements antibiotiques chez les bactéries est un problème de santé publique majeur. Dans un article publié dans PLOS Pathogens, des scientifiques ont analysé systématiquement les trajectoires passées des résistances dans huit espèces bactériennes majeures. Leur étude montre que la plupart des résistances se stabilisent après une phase initiale d'augmentation et ouvre de nouvelles perspectives pour mieux les contrôler.
Comment mieux comprendre l’évolution des résistances aux antibiotiques ?
De nombreuses espèces bactériennes sont à la fois des « bonnes bactéries » commensales et bénignes pour nous, mais aussi des pathogènes dits « opportunistes » lorsqu’elles envahissent des parties de notre corps où elles ne devraient pas être présentes. Par exemple, la bactérie Escherichia coli se multiplie paisiblement dans le gros intestin de quasi tous les êtres humains. Mais elle envahit parfois d’autres organes, comme la vessie, les reins ou la prostate, voire peut passer dans le flux sanguin. Ces infections peuvent être graves et nécessitent un traitement antibiotique. Le traitement des infections est désormais compliqué par le fait qu’une proportion des bactéries est résistante aux antibiotiques. Or, traiter une infection résistante est plus long et plus difficile.
Ces résistances émergent quand l’antibiotique correspondant est consommé massivement dans la population. Mais il n’est pas possible de prédire en détail comment les résistances présentes à l’heure actuelle vont évoluer dans le futur. Pourtant, il est très important de pouvoir développer de telles projections afin d’anticiper l’impact des résistances sur la santé humaine.
Pour avancer dans cette direction, dans une étude publiée dans la revue PLOS Pathogens, des scientifiques ont systématiquement caractérisé les trajectoires passées des résistances sur plus de 20 ans (1998-2019), dans huit espèces bactériennes d’importance majeure. Ils ont examiné un jeu de données de taille exceptionnelle rassemblé au fil des années par le Centre européen de contrôle et de prévention des maladies. Ce jeu de données centralise les profils de résistance à un panel d’antibiotiques de millions d’isolats bactériens collectés dans 30 pays européens chez des patients infectés. Les scientifiques ont systématiquement caractérisé les trajectoires temporelles de la proportion de résistance pour 887 combinaisons de pathogènes, antibiotiques et pays.
Les résistances, une fois stabilisées, évoluent peu au cours du temps
Les résultats montrent, de façon surprenante, que la plupart des résistances ont une trajectoire stable avec peu d’évolution au cours du temps. Certaines résistances (correspondant aux résistances récemment émergées) ont augmenté en fréquence dans les années 2000, mais se sont ensuite, elles aussi, stabilisées. Cette stabilisation ou stabilité était déjà bien connue pour certaines espèces comme Streptococcus pneumoniae (le pneumocoque) mais jamais encore démontrée de façon systématique dans un jeu de données de grande ampleur couvrant de multiples espèces d’intérêt.
Qu’est-ce qui explique la vitesse initiale d’augmentation des résistances émergentes et leur niveau de stabilisation ? Les scientifiques ont exploité la grande variabilité de ces trajectoires entre pays pour tenter de répondre à cette question. Dans les grandes lignes, un pays où la consommation d’antibiotiques est plus élevée verra une émergence plus rapide des nouvelles résistances, et un niveau de stabilisation plus élevé. Il y a néanmoins beaucoup de variabilité autour de cette tendance.
Une fois stabilisées, les résistances continuent-elles d’évoluer ? L’étude montre que les légères augmentations, diminutions ou fluctuations des résistances sont associées avec les variations correspondantes d’utilisation des antibiotiques dans les hôpitaux, mais non dans la communauté. Bien que ce signal soit faible, cela pourrait suggérer que les variations d’usage d’antibiotiques dans les hôpitaux sont un facteur modulant.
L’évolution vers une plus grande résistance est évitable.
Tous ces résultats suggèrent un modèle d’évolution des résistances aux antibiotiques en « plateau » : après l’émergence et l’augmentation rapide de la résistance, la fréquence de la résistance dans une espèce donnée se stabilise. Cela signifie que l’évolution vers une plus grande résistance n’est donc pas inévitable, et que ces espèces bactériennes ne deviendront pas complètement « pan-résistantes » et impossibles à traiter. Par ailleurs, la résistance est associée à l’usage d’antibiotiques, ce qui signifie que le contrôle de la résistance est possible. Cette étude dresse un portrait à grands traits de l’évolution des résistances aux antibiotiques dans les pays européens, mais montre aussi que beaucoup reste à faire. Il faudra en particulier caractériser ces trajectoires sur d’autres continents, mieux comprendre les déterminants de ces trajectoires et les mécanismes populationnels sous-jacents. Cela est important pour mieux anticiper notre capacité future à traiter les infections bactériennes dans le futur.
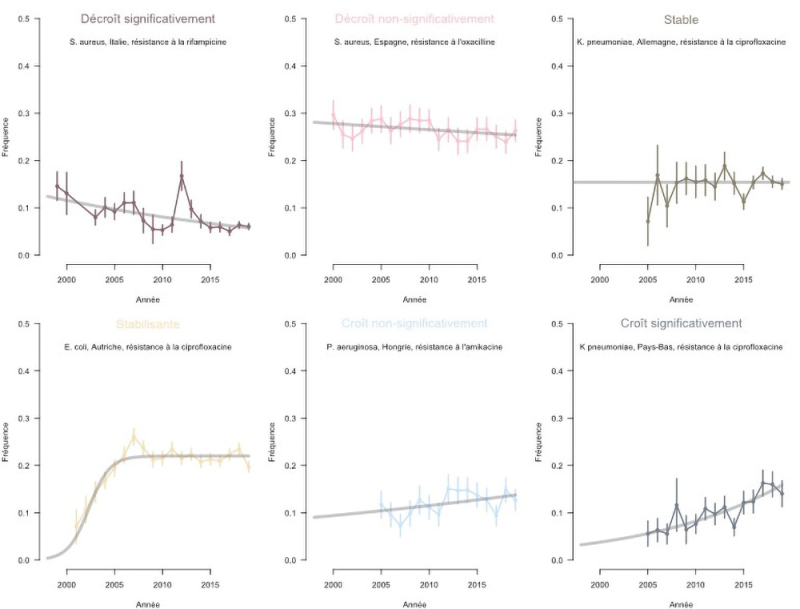
Figure : illustration de la classification des trajectoires de résistance aux antibiotiques. Chaque panneau montre la fréquence d'une résistance en fonction du temps, pour un type de trajectoire. Les trajectoires les plus fréquentes sont "Stable" et "Stabilisante". La courbe grise montre le modèle qui est ajusté aux données pour chaque type de trajectoire.
Référence : Emons M, Blanquart F, Lehtinen S. The evolution of antibiotic resistance in Europe, 1998-2019. PLoS Pathog. 2025 Apr 3;21(4):e1012945. doi: 10.1371/journal.ppat.1012945. PMID: 40179072; PMCID: PMC11967945.
Contact
Laboratoire
Centre interdisciplinaire de recherche en biologie - CIRB (CNRS/Collège de France/Inserm)
11 place Marcelin Berthelot
75005 Paris
