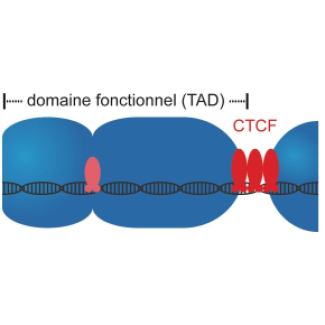
Les frontières au sein de nos chromosomes façonnent les domaines fonctionnels adjacents
Les chromosomes des mammifères, y compris ceux des humains, sont organisés en plusieurs milliers de « domaines fonctionnels » qui sont séparés par des frontières dédiées. Ces frontières cloisonnent l’activité biologique et empêchent les interférences entre les domaines voisins. Dans une étude publiée dans la revue Proceedings of the National Academy of Sciences of the United States of America (PNAS), des scientifiques montrent que les frontières entre domaines fonctionnels adjacents ont une influence inattendue sur l’organisation même de ces domaines.
Les chromosomes sont constitués de domaines fonctionnels séparés par des frontières
Les chromosomes des mammifères, dont ceux de l’Homme, sont au cœur d’activités biologiques essentielles. De nombreux mécanismes y convergent afin d’assurer la régulation de l'expression des gènes, la réparation de l’ADN pour maintenir son intégrité et la réplication de l'ADN pour permettre la division cellulaire. Pour optimiser localement ces processus et éviter toute interférence, les chromosomes sont compartimentés en plusieurs milliers de « domaines fonctionnels » également appelés « domaines d'association topologique » ou « TAD ». Lorsque les frontières de ces domaines sont perturbées et que des domaines adjacents fusionnent, cela peut entraîner des pathologies graves, notamment des cancers ou des troubles du développement.
Une étude multidisciplinaire, publiée dans la revue Proceedings of the National Academy of Sciences of the United States of America (PNAS), explore comment ces frontières influencent l’organisation des chromosomes en domaines fonctionnels adjacents.
Une grande diversité de la taille des frontières
En combinant des analyses génomiques, des modélisations biophysiques et des simulations stochastiques de polymères (des représentations numériques des chromosomes), les scientifiques ont découvert que la taille de ces frontières varie considérablement dans les cellules souches de souris. Certaines frontières apparaissent très étroites sur le chromosome, alors que d’autres forment des zones de transition plus étendues entre les deux domaines. Cette diversité est directement liée à la liaison à l'ADN d’une protéine clé dans la formation des frontières, appelée CTCF, dont le nombre de sites de liaison augmente avec l’étendue des frontières.
Modéliser le chromosome pour mieux comprendre le rôle des frontières
Les scientifiques ont utilisé ces observations pour calibrer des modèles de polymères permettant d’examiner le comportement de paires de domaines fonctionnels séparés par des frontières de tailles différentes. Le développement de ces nouveaux modèles de polymères, qui intègrent à la fois les informations de localisation de la protéine CTCF et la structure grossière de la chromatine, a permis de réaliser des simulations numériques accélérées. Ces dernières ont révélé un impact inattendu : plutôt que de créer une séparation statique, les frontières influencent activement l’organisation des domaines adjacents. En particulier, elles exercent un effet d’enroulement sur les deux domaines adjacents, un rôle qui leur était inconnu jusqu'alors.
Ces simulations montrent également que les frontières étroites favorisent activement le brassage entre les domaines, pouvant provoquer des interférences dans les activités biologiques qui s’y déroulent. À l’inverse, les frontières plus étendues limitent ce mécanisme en renforçant la séparation des deux domaines. En revisitant les données génomiques issues de cellules de souris, les scientifiques ont pu confirmer l’impact de la taille des frontières sur la séparation des domaines voisins. Ce travail illustre la valeur exploratoire de cette approche interdisciplinaire combinant génomique et modélisation biophysique.
Les scientifiques proposent que la structure des frontières pourrait constituer une nouvelle couche régulatrice permettant d’affiner les activités biologiques des chromosomes. La taille des frontières et leur modulation joueraient ainsi un rôle clé dans la régulation fine de l'activité des gènes. Au cours de l'embryogenèse, l’ajustement des interactions entre domaines adjacents, par modulation de la taille des frontières, pourrait influencer l’activité génique dans un sous-ensemble de cellules et ainsi orienter l’émergence de nouvelles identités cellulaires.
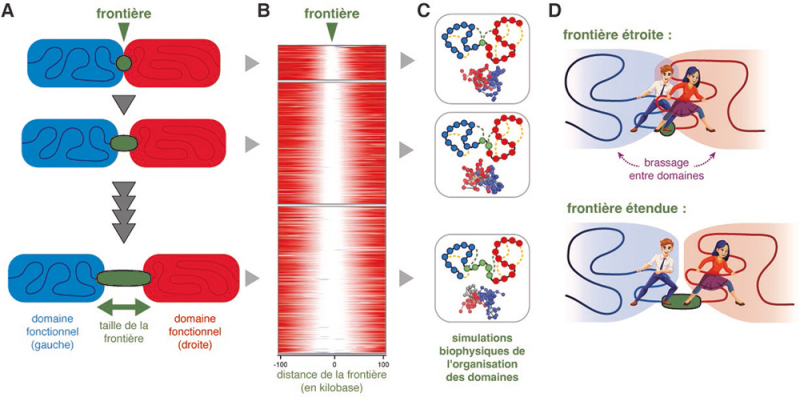
Figure : A. Les domaines chromosomiques fonctionnels adjacents (bleu et rouge) sont séparés par des frontières (vert). Cette étude a exploré la diversité de la taille des frontières et son impact sur l'organisation des deux domaines concernés. B. Une analyse génomique des frontières dans des cellules de souris, en utilisant la technologie Hi-C, révèle la variabilité de l’étendue des frontières. Ce panneau présente ~3500 frontières détectées dans des cellules souches embryonnaires de souris, empilées les unes sur les autres. La zone blanche correspond à la frontière entre domaines adjacents, dont l’étendue augmente du haut en bas sur le panneau (signal du score d'isolation Hi-C dans une fenêtre de 200 kilobases centrées sur le milieu des frontières). C. Les résultats de l'analyse génomique ont été utilisés pour calibrer des modèles biophysiques simulant le comportement de deux domaines fonctionnels adjacents séparés par des frontières de taille variable (modèles de billes reliées par des ressorts). À l'aide de ces modèles calibrés, des centaines de simulations computationnelles ont révélé que les frontières influencent directement l’organisation des domaines voisins : les frontières induisent un enroulement des deux domaines adjacents (indiqués par les lignes pointillées vertes), favorisant un brassage accru entre les domaines lorsque la frontière est étroite. D. Schéma illustrant l’effet de l'enroulement du brin chromosomique sur les deux domaines voisins, dans le cas d’une frontière étroite (en haut) favorisant le brassage ou d’une frontière plus étendue (en bas) limitant cet effet. En conséquence, les frontières étroites peuvent accentuer les interférences fonctionnelles entre domaines.
Référence : Insulation between adjacent TADs is controlled by the width of their boundaries through distinct mechanisms. Papale A*, Segueni J*, El Maroufi H, Noordermeer D# and Holcman D#.
PNAS, 10 mars 2025, DOI : https://www.pnas.org/doi/10.1073/pnas.2413112122
Contact
Laboratoires
Institut de Biologie Intégrative de la Cellule - I2BC (CNRS/Université Paris-Saclay/CEA)
Avenue de la Terrasse
91190 Gif-sur-Yvette - FRANCE
Institut de biologie de l'Ecole Normale Supérieure - IBENS (CNRS/ENS PSL/Inserm)
ENS - PSL
46 rue d'Ulm
75230 Paris - FRANCE