Dérégulation de l’inactivation du chromosome X dans la sclérodermie systémique
Certaines maladies auto-immunes comme la sclérodermie ou le lupus érythémateux systémique touchent plus fréquemment les femmes que les hommes. Dans un article publié dans The Journal of Experimental Medicine, des scientifiques montrent qu’un dysfonctionnement de l’inactivation du chromosome X, pourrait contribuer à des réponses immunitaires excessives chez les femmes atteintes de ces maladies.
Les femmes ont une meilleure capacité à lutter contre les infections que les hommes, mais aussi une plus grande susceptibilité à développer une maladie auto-immune. Comprendre l’origine de cette différence est un enjeu primordial pour mieux les traiter. Si les hormones stéroïdes sexuelles ont été étudiées pour expliquer cette différence entre femmes et hommes, une nouvelle piste concerne le chromosome X. Les femmes ont deux chromosomes X contre un seul chez les hommes, mais l’un des deux est normalement inactivé. Bien que maintenue tout au long de la vie dans les cellules différenciées, cette inactivation est imparfaite et certains gènes peuvent échapper à l’inactivation ou être réactivés à partir du chromosome X inactif dans certains tissus ou chez certains individus. Cela a conduit à émettre l’hypothèse que l’expression dérégulée de gènes de l’immunité liés au chromosome X pourrait contribuer à la susceptibilité accrue des femmes à développer de telles maladies en augmentant leur réponse immune.
Un rôle clé pour les gènes du locus TLR7/TLR8 dans la sclérodermie.
La sclérodermie systémique (SSc) est une maladie auto-immune qui touche environ 10 000 patients en France dont 80% de femmes. Les produits des gènes des récepteurs Toll-like TLR7 et TLR8, situés sur le chromosome X, peuvent être activés par des acides nucléiques endogènes et induire la production d’interferon de type I (IFN-I) par les cellules dendritiques plasmacytoïdes (pDC), favorisant la fibrose caractéristique de cette maladie. Des travaux antérieurs ont mis en évidence que ces gènes peuvent échapper à l’inactivation du chromosome X dans les cellules immunitaires humaines. Analyser les pDCs qui représentent une population rare de cellules dans le sang est un « tour de force » auquel se sont attaquées les scientifiques.
Dans cette étude collaborative publiée dans The Journal of Experimental Medicine ils ont étudié le transcriptome à l’échelle de la cellule unique des pDCs de femmes saines et atteintes de SSc. Cette technique permet de détecter l’ensemble des gènes exprimés à un moment donné dans la cellule. Ils ont identifié chez les femmes atteintes de SSc des populations distinctes de pDCs possédant une signature caractéristique d’une réponse associée aux IFN de type I, molécule pouvant aggraver l’inflammation et provoquer des dégâts aux tissus. Ils ont en parallèle observé que les gènes TLR7 et TLR8 échappent tous deux à l'inactivation du chromosome X à une fréquence plus élevée dans les pDC des patientes atteintes de SSc, suggérant que la surexpression de ces gènes pourrait contribuer à l’activation chronique des pDCs chez les patientes atteintes de sclérodermie.
Un lien entre échappement à l’inactivation du chromosome X et modification 3D de la chromatine sur le X inactif
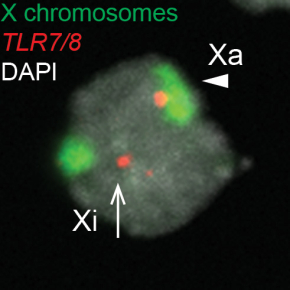
Les scientifiques ont ensuite utilisé des techniques de pointe d’imagerie pour étudier la conformation 3 D de la chromatine dans les pDCs. L'analyse a révélé que lorsque TLR7 est exprimé sur le chromosome sensé être inactif dans les cellules, alors le locus TLR7/8 est préférentiellement situé sur une boucle qui se place en dehors du territoire du chromosome X. Cela suggère que l’anomalie d’expression de TLR7 sur le X inactif nécessite une réorganisation complète de la chromatine sur ce chromosome.
A l’échelle unicellulaire, ils ont également observé que les acteurs clés de l’inactivation de l’X, tels que le long ARN non-codant XIST et le répresseur transcriptionnel SPEN, sont plus faiblement exprimés dans les pDCs de femmes sclérodermiques.
Ces résultats révèlent l’hétérogénéité des pDCs dans la sclérodermie et suggèrent que l’altération de l’inactivation du X au niveau du locus TLR7/8 pourrait contribuer à l’activation chronique des pDCs dans cette maladie. La compréhension des mécanismes génétiques à l’origine de l’expression dérégulée des gènes à partir du chromosome X inactif dans les cellules immunitaires pourrait conduire au développement d’approches ciblées sur ce chromosome pour le traitement des maladies auto-immunes chez les femmes.
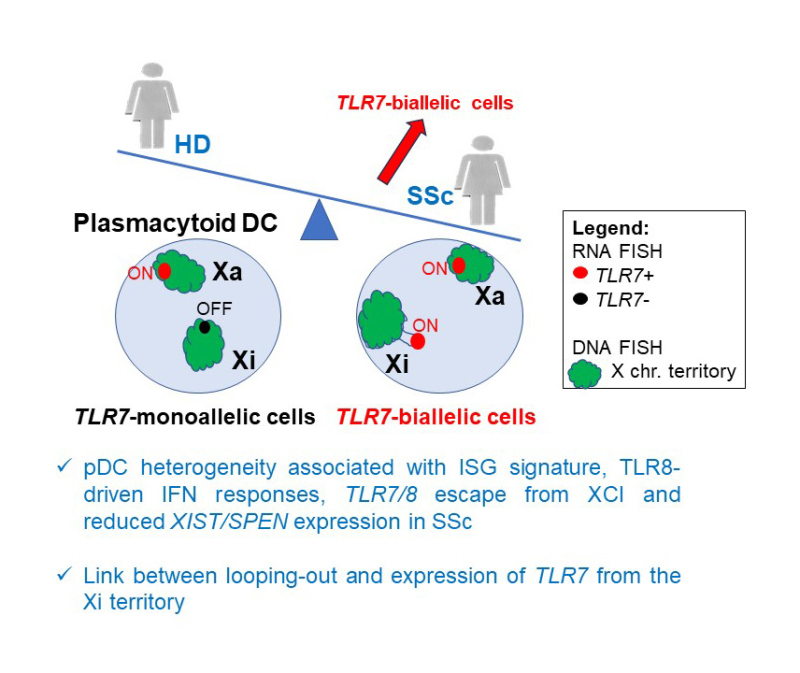
Figure : L’analyse des transcrits primaires des gènes TLR7/8 par hybridation in situ (RNA FISH) dans les cellules dendritiques plasmacytoïdes (pDCs) montre une fréquence plus élevée de cellules bi-alléliques dans les pDCs des patientes SSc par rapport aux femmes saines (HD), associée à une signature ISG et des réponses IFN induites par TLR8 augmentées dans les pDC SSc. L'analyse combinée en FISH ADN et ARN a révélé que le locus TLR7/8 est préférentiellement situé en dehors du territoire de l’X inactif (Xi) lorsque TLR7 est exprimé, suggérant que la réorganisation du territoire chromosomique avec la formation de boucles est liée à l'expression de TLR7/8 à partir du Xi dans les pDCs de femmes.
En savoir plus : Du Y, Faz-Lopez B, Ah Kioon M-D, Cenac C, Pierides M, Lakin K, Spiera RF, Chaumeil J, Truchetet M-E, Gordon JK, Guéry J-C and Barrat FJ.Altered X chromosome inactivation of the TLR7/8-locus is associated with enhanced IFN signature in pDCs in systemic sclerosis. J. Exp. Med. 2025 222(3): e20231809. https://doi: 10.1084/jem.20231809
Contact
Laboratoires
Institut toulousain des maladies infectieuses et inflammatoires - INFINITy (CNRS/Inserm/Université Toulouse Paul Sabatier)
CHU Purpan-Centre Physiopathologie
Place du Dr Baylac
31024 Toulouse
HSS Research and David Z. Rosensweig Genomics Research Center
Department of Microbiology and Immunology, Weill Cornell Medical College of Cornell University
HSS Research Institute, 535 East 70th Street, New York, NY 10021, USA