Structure atomique complexe de TIP60C humain, un acteur clé dans la régulation de la structure de la chromatine
Dans un article publié dans Nature, des scientifiques ont utilisé la cryo-microscopie électronique pour observer, à l’échelle atomique, un complexe essentiel au remodelage de la structure de la chromatine chez l’homme, TIP60C. Contrairement à ce qui était connu chez la levure ou ces fonctions sont séparés en deux complexes, TIP60-C combine les activités des deux complexes en une structure trilobée unique. Ces travaux ouvrent des perspectives innovantes pour comprendre le fonctionnement spécifique de ce remodeleur chez l’homme et ouvrent à la voie à de nouvelles perspectives thérapeutiques.
Le complexe TIP60-C : un acteur clé dans la régulation de l’ADN.
Dans nos cellules, l’ADN, porteur de l’information génétique, est compacté en une structure appelée chromatine. La chromatine repose sur une organisation en unités répétées, les nucléosomes, constitués de protéines histones autour desquelles l’ADN s’enroule. Cette structure joue un rôle clé dans l’accessibilité de l’information génétique et régule des processus comme la transcription des gènes, la réplication de l’ADN et sa réparation. Ces fonctions sont modulées par des "machines moléculaires" qui modifient les histones ou déplacent les nucléosomes en utilisant l’énergie de l’ATP.
Chez l'homme, le complexe TIP60/EP400 (TIP60-C) est un assemblage de 20 sous-unités qui réorganise la chromatine grâce à deux fonctions principales : l’échange spécifique de certaines histones et leur modification chimique (acétylation). Chez la levure, ces deux activités sont réalisées par deux complexes indépendants appelés SWR1 et NuA4. On ne sait pas comment ces activités sont fusionnées chez l'homme en un super-complexe ni ce que cette association implique pour leur structure, leur mécanisme et leur recrutement sur la chromatine.
Dans un article publié dans la revue Nature, les scientifiques décrivent la structure du complexe endogène TIP60-C humain à une résolution de 2,4 à 3,3 Å, c’est-à-dire à une résolution qui permet de voir chaque résidu de la molécule.
Plus précisément ils montrent queTIP60-C adopte une architecture à trois lobes, composée de parties similaires à SWR1 (SWR1L) et NuA4 (NuA4L), qui s'associent à un module TRRAP de liaison aux activateurs transcriptionnels. La très grande sous-unité EP400 abrite le moteur ATPase, traverse deux fois la jonction entre SWR1L et NuA4L, et constitue l’armature de l'organisation trilobée. NuA4L est complètement réorganisée par rapport à son homologue de levure. TRRAP est attaché de manière flexible à NuA4L, ce qui contraste fortement avec sa connexion robuste trouvée chez l’homologue NuA4 de levure. La modélisation d’un nucléosome lié à SWR1L, soutenue par des tests d'activité, suggère que certains aspects du mécanisme d'échange d'histones divergent du mode d’action de la levure, indiquant que de nouvelles propriétés émergent de l’association des deux entités.
Perspective en biologie et médecine
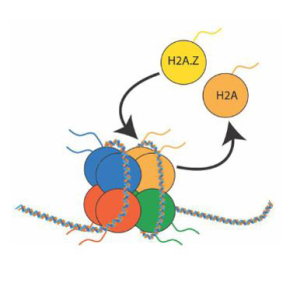
TIP60-C n’est pas seulement une machine enzymatique ; il joue aussi un rôle stratégique dans l’organisation et l’adaptabilité de la chromatine. En remplaçant le variant histonique H2A.Z, il influence directement la structure du nucléosome, facilitant l’accès à l’ADN pour des facteurs de transcription ou des enzymes de réparation. Ce processus est crucial pour des décisions cellulaires telles que la différenciation ou la réponse aux dommages.
Sur le plan thérapeutique, TIP60-C se révèle particulièrement prometteur. Les études montrent que son inhibition pourrait être exploitée pour traiter certains cancers où le remodelage de la chromatine est perturbé. En combinant des inhibiteurs de TIP60-C avec des altérations du complexe SWI/SNF, souvent impliqué dans les cancers, des approches ciblées pourraient voir le jour. Cette découverte ouvre de nouvelles pistes pour la médecine de précision, tout en contribuant à une meilleure compréhension des mécanismes épigénétiques humains.
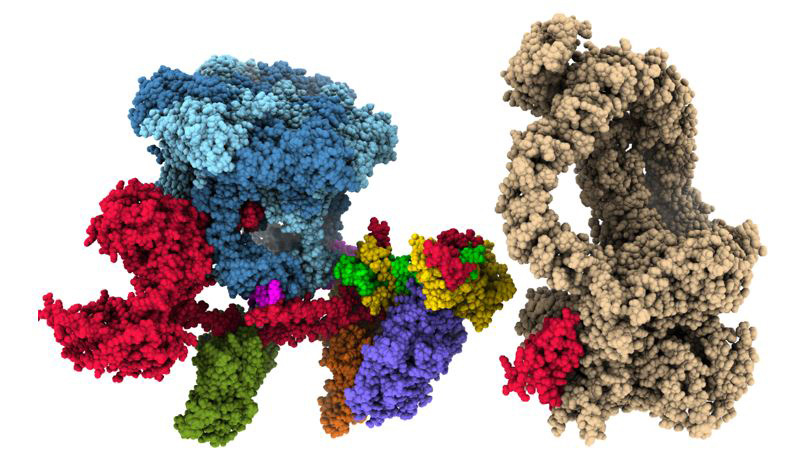
Figure : Organisation structurale du complexe multiprotéique TIP60-EP400
En savoir plus : Li, C., Smirnova, E., Schnitzler, C. et al. Structure of the human TIP60-C histone exchange and acetyltransferase complex. Nature 635, 764–769 (2024). https://doi.org/10.1038/s41586-024-08011-w
Contact
Laboratoire
Institut de Génétique et de Biologie Moléculaire et Cellulaire - IGBMC (CNRS/Inserm/Université de Strasbourg)
1 rue Laurent Fries,
Illkirch-Graffenstaden, France