NR5A2, un facteur essentiel au démarrage du développement embryonnaire
Après la fécondation, l'embryon de mammifère se divise et génère plusieurs types de cellules nécessaires à son implantation dans l'utérus et à l’élaboration du futur fœtus. Dans un article publié dans la revue Science des scientifiques montrent qu'une protéine, appelée NR5A2, contribue à activer l'expression de gènes qui définissent l'identité des premières cellules embryonnaires. En plus de provoquer la dérégulation de milliers de gènes, son absence entraîne des défauts pendant l’exécution des premières divisions cellulaires, et l'embryon meurt au bout de quelques jours seulement.
Au cours des quelques jours qui suivent la fécondation, l'embryon de mammifère, composé au départ d'une seule cellule, se divise et génère plusieurs types de cellules nécessaires à son implantation dans l'utérus et à l’élaboration du futur fœtus. Certaines cellules formeront les annexes extra-embryonnaires, placenta et sac vitellin, qui entourent et protègent l'embryon et contribuent à fournir des nutriments à l'embryon. D’autres cellules dites pluripotentes, vont générer tous les tissus du fœtus après l'implantation. Ce processus, connu sous le nom de « spécification des lignages », implique que les cellules embryonnaires précoces acquièrent des identités différentes, chacune caractérisée par l'expression de différents ensembles de gènes. Au démarrage, le génome embryonnaire est inactif et doit donc être d'abord « réveillé », puis rendu apte à mettre en route les réseaux de régulation génique spécifiques de chaque type cellulaire. La manière dont cela se déroule est incertaine.
Sans NR5A2, l’embryon commence à se développer mais meurt peu après.
Des travaux antérieurs suggéraient qu’ une protéine capable de réguler l’expression des gènes, le facteur de transcription nommée NR5A2, joue des rôles importants à ces stades précoces. Pour confirmer cette hypothèse, nous avons généré des souris chez lesquelles le gène Nr5a2 est génétiquement inactivé, de sorte que l'embryon se développe en l'absence totale de ce facteur. Ceci nous a permis de montrer que NR5A2 participe à l'activation du génome, mais qu’il n'est pas essentiel à ce processus. Plus tard, une fois le génome embryonnaire activé, le rôle de NR5A2 devient crucial. Ce facteur de transcription se lie à des milliers d'endroits sur l’ADN et contrôle l'expression d'autres régulateurs de la spécification des lignages embryonnaires. Il contrôle également l’expression de gènes nécessaires à l'exécution de fonctions fondamentales, telles que la division cellulaire et la protection de l’ADN contre les dommages. Ainsi, NR5A2 active les réseaux géniques permettant la spécification des trois premiers lignages embryonnaires, tout en maintenant l’intégrité du génome. Cette fonction est si importante que, sans NR5A2, l'embryon meurt quelques jours après la fécondation. Cette étude a donc permis d’identifier un acteur clé de la période du développement qui relie l'activation du génome embryonnaire au début des premiers changements d’identité cellulaire, période pour laquelle les acteurs moléculaires étaient jusqu’alors méconnus.
Des résultats importants pour améliorer l’efficacité des fécondations in vitro et l’utilisation des cellules souches pluripotentes.
Ces études sont poursuivies en utilisant des systèmes qui permettent de contourner ce rôle précoce de NR5A2 et d’étudier sa fonction dans des cellules qui ont déjà entamé la spécification des lignages. En utilisant comme modèle des cellules souches embryonnaires, qui sont des lignées cellulaires dérivées d'embryons préimplantatoires, les scientifiques ont effectivement montré que NR5A2, ainsi qu'un facteur apparenté ESRRB, pourraient aussi être requis pour le maintien de la pluripotence. En apportant une meilleure compréhension des premières étapes du développement de l’embryon de mammifères et sur la façon dont il se prépare à s'implanter dans l'utérus, ce travail pourrait permettre de concevoir des stratégies plus efficaces et mieux contrôlées pour la fécondation in vitro. De même, savoir comment les cellules embryonnaires acquièrent et conservent un potentiel de différenciation illimité est susceptible d’impacter l'utilisation des cellules pluripotentes dans les thérapies de remplacement cellulaire.
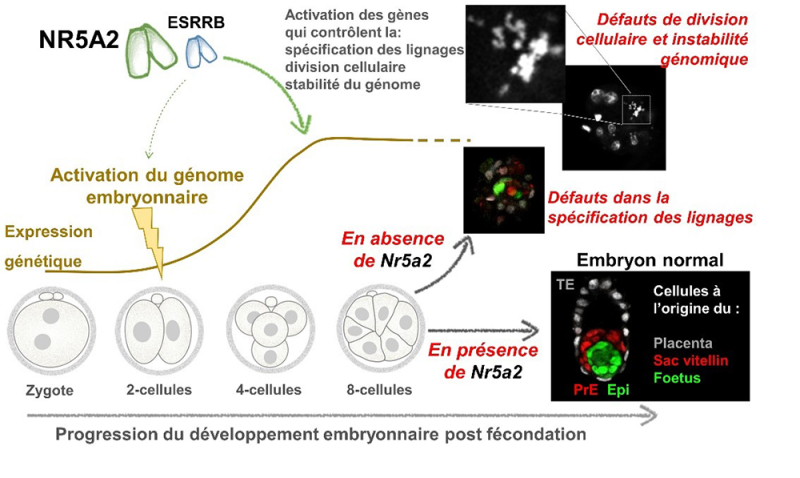
Figure : Après l'activation du génome embryonnaire, NR5A2 contrôle l'expression de facteurs clés qui définissent l'identité des types de cellules qui composent l'embryon précoce, mais aussi de gènes impliqués dans la division cellulaire et la réponse aux lésions de l'ADN. En conséquence, en l'absence de NR5A2, des milliers de gènes sont mal exprimés, des signes clairs d'instabilité génomique se manifestent et le développement embryonnaire déraille quelques jours après la fécondation.
En savoir plus : Festuccia N, Vandormael-Pournin S, Chervova A, et al. Nr5a2 is dispensable for zygotic genome activation but essential for morula development. Science. 2024;386(6717):eadg7325. doi:10.1126/science.adg7325
Contact
Laboratoire
Département de Biologie du développement et cellules souches (CNRS/Institut Pasteur)
25 Rue du Docteur Roux,
75015, Paris