Traduction oui, mais compartimentée
Les cellules sont très compartimentées. On y trouve des organelles entourées de membranes mais aussi des compartiments sans membrane, les condensats biomoléculaires dont la relation entre structure et fonction est très mal connue. Dans une étude publiée dans Nature Communications, des scientifiques démontrent, en utilisant le modèle drosophile, la compartimentation fonctionnelle de ces condensats.
Compartimentation cellulaire et condensats biomoléculaires.
Le milieu cellulaire est extrêmement dense, renfermant des milliards de molécules. Ainsi, dans un tel environnement, comment une molécule spécifique parvient-elle à rencontrer ses partenaires? Les cellules ont élaboré des mécanismes de compartimentation de différentes fonctions cellulaires, regroupant dans l'espace les facteurs opérant ensemble. Cette organisation met en œuvre des organelles entourées de membranes, mais plus récemment la formation de condensats biomoléculaires sans membrane s'est imposée comme un autre mécanisme essentiel à la compartimentation cellulaire. Ces condensats formés d'acides nucléiques et protéines se forment selon le principe de séparation de phase: les molécules atteignant un seuil de concentration s'agrègent par une multitude d'interactions et se séparent de leur environnement pour former un condensat dépourvu de membrane. Ces condensats contribuent à coordonner les réactions biochimiques, augmentant leur efficacité. Les granules d'ARN, des condensats composés d'ARN et de protéines liant les ARNs, jouent le rôle de véritables plateformes de régulation génique. En fonction de leurs constituants, ils assurent le stockage des ARN messagers, leur tri, ou agissent comme des usines de traduction. Un nombre croissant d'études montre que ces granules sont eux-mêmes sous-compartimentés, avec une distribution différentielle de leurs composants, cependant les liens entre la structure des granules et leurs fonctions restent énigmatiques. Comprendre les relations entre ces différents sous-compartiments et les diverses fonctions régulatrices des granules d'ARN représente un défi majeur pour notre compréhension de la biologie cellulaire, mais aussi en santé car ces granules d'ARN jouent un rôle central dans de nombreuses maladies neurodégénératives où ils sont altérés de façon pathologique.
Des résultats qui démontrent la compartimentation fonctionnelle des condensats.
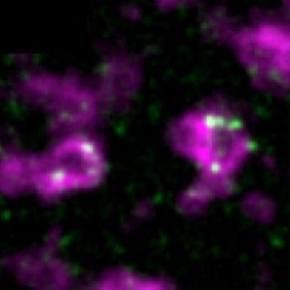
Pour étudier ces questions, les scientifiques, dans un article publié dans la revue Nature Communications, ont utilisé les granules germinaux de l'embryon de drosophile, un modèle remarquable de granules d'ARN, du fait de leur étude de longue date par des approches génétiques et fonctionnelles. Les granules germinaux sont le centre de régulation d'ARN messagers qui permettent la spécification et le développement des cellules germinales. S'appuyant sur un ensemble de techniques innovantes d'imagerie en molécule unique et de microscopie à super-résolution, les scientifiques ont montré que les granules germinaux sont composés de deux phases : une phase externe où s'accumulent les protéines et une phase interne riche en ARN messagers. Grâce à une technique d'imagerie permettant de visualiser la traduction en temps réel dans la cellule (la technique Suntag), couplée à la microscopie à super-résolution, ils ont montré qu’elle est restreinte à la phase externe ; les ARN messagers non-traduits s'accumulent sous forme compactée dans la phase interne. Ils montrent, de plus, que la compaction des ARN messagers et leur localisation dans la phase interne, loin de la machinerie de traduction, est l’un des mécanismes de répression traductionnelle. Ainsi les ARN messagers se déplacent du centre vers la phase externe pendant leur traduction. Finalement, la perte de cette structure biphasique conduit à une forte diminution de l'activation traductionnelle, démontrant les liens étroits entre l'architecture des granules et leurs fonctions.
Ces travaux révèlent la compartimentation fonctionnelle des condensats biomoléculaires, offrant une nouvelle vision du rôle de ces condensats dans l'organisation des fonctions cellulaires. Ils ouvrent, de plus, des perspectives très prometteuses sur la compréhension de certaines maladies neurodégénératives ou dystrophies musculaires liées à l'altération pathologique de ces condensats.
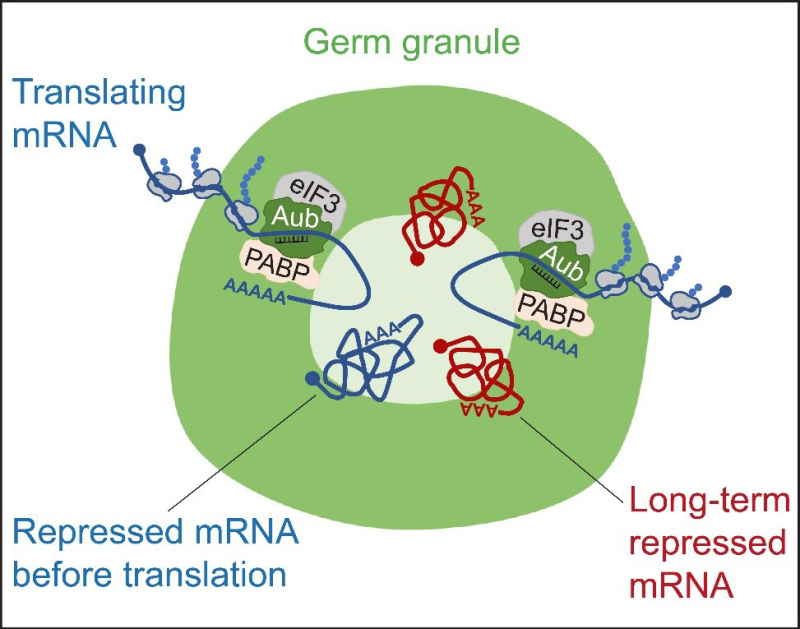
Figure : Modèle de compartimentation fonctionnelle des granules germinaux. Le schéma représente un granule germinal biphasique dont les principaux composants protéiques s’accumulent dans la phase externe (vert). Les ARNm réprimés s'accumulent dans la phase interne du granule sous forme compactée. Les ARNm sont traduits dans la phase externe où se trouvent les facteurs d'initiation de la traduction (eIF3 et PABP). Aub qui recrute eIF3 et PABP est l'activateur traductionnel spécifique des granules germinaux. Les ARNm traduits sont décompactés et ancrés à la phase interne du granule par leur région 3', tandis que leur extrémité 5' est orientée vers la phase externe et la périphérie du granule. Les ARNm se déplacent de la phase interne vers la phase externe pendant la traduction.
En savoir plus : Ramat, A., Haidar, A., Garret, C. et al. Spatial organization of translation and translational repression in two phases of germ granules. Nat Commun 15, 8020 (2024). https://www.nature.com/articles/s41467-024-52346-x
Contact
Laboratoire
Institut de génétique humaine – IGH (CNRS/Université de Montpellier)
141 rue de la Cardonille,
34396 Montpellier Cedex 5