Maladie neurodégénérative : une piste prometteuse pour détruire spécifiquement les agrégats protéiques neurotoxiques
Dans une famille de maladies neurodégénératives, des protéines tau s’agrègent dans le cerveau, ce qui conduit à une neurotoxicité. Dans un article publié dans la revue Science, des scientifiques ont développé une stratégie permettant de cibler et détruire les formes agrégées de la protéine Tau sans dégrader la protéine normale.
La protéine Tau est impliquée dans de nombreuses maladies dégénératives.
L’une des caractéristiques majeures des maladies neurodégénératives est l’agrégation de certaines protéines qui s’accumulent au sein des neurones, empêchant leur fonctionnement normal. Dans la maladie d’Alzheimer et maladies apparentées appelées tauopathies, la protéine tau, protéine associée au cytosquelette, s’agrège en filaments. Ces dépôts au sein des neurones conduisent à un dysfonctionnement des connections neuronales et une mort cellulaire, sous-jacents au développement des troubles cognitifs.
Empêcher l’agrégation des protéines tau ou favoriser la dégradation des protéines Tau agrégées sont de potentielles approches thérapeutiques pour ce type de maladies. Lors de travaux précédents, les scientifiques ont développé et caractérisé des nanocorps anti-tau. Ils ont ainsi montré que ces nanobodies reconnaissent la protéine Tau à l’intérieur des cellules, permettant de la cibler spécifiquement. Les nanocorps (ou VHHs) sont des petits anticorps à domaine unique qui peuvent être assemblés comme des briques LEGO® et élargir leurs fonctions et adressage cellulaire. Ils peuvent être couplés à des enzymes permettant de développer des complexes moléculaires ayant de nouvelles fonctions.
Des anticorps capables de provoquer la dégradation de la protéine Tau agrégée.
Les scientifiques ont ensuite découvert que la protéine Tau, complexée à un anticorps, pouvait être internalisée dans les cellules et dégradée par le protéasome, un système de dégradation protéique, grâce à une ligase appelé TRIM21, une enzyme qui favorise la jonction entre deux molécules. TRIM21 présente la particularité de ne reconnaître que des complexes de plusieurs molécules, qu’elle est alors capable de marquer avec des étiquettes ubiquitine, permettant ainsi leur reconnaissance comme protéines indésirables à éliminer par la machinerie cellulaire.
Sur base de ces expertises les scientifiques dans un article publié dans la revue Science, ont utilisé les nanocorps anti-tau pour imaginer une construction moléculaire qui ne reconnait que les formes agrégées de Tau. Cette construction consiste en la fusion d’un nanocorps anti-tau au domaine actif (appelé RING) de TRIM21. Cette construction, ou « Triminator », favorise la dégradation efficace et rapide des agrégats de Tau dans des modèles cellulaires tandis que la protéine Tau soluble n'est pas dégradée, préservant ainsi ses fonctions importantes dans la cellule. L’expression intracellulaire des dégradeurs « Triminator » permet d’éliminer les agrégats de Tau dans des cellules en culture mais aussi in vivo dans un modèle de souris transgénique
Les résultats suggèrent que les agrégats de Tau peuvent être sélectivement éliminés du cerveau tout en épargnant la protéine Tau normale monomérique. Les nouveaux outils moléculaires développés pourront être utilisés pour interrogés des mécanismes biologiques qui conduisent au dépôt anormal de protéine au sein de cellules. Le potentiel thérapeutique de ces constructions en induisant la dégradation de la protéine Tau est à l'étude.
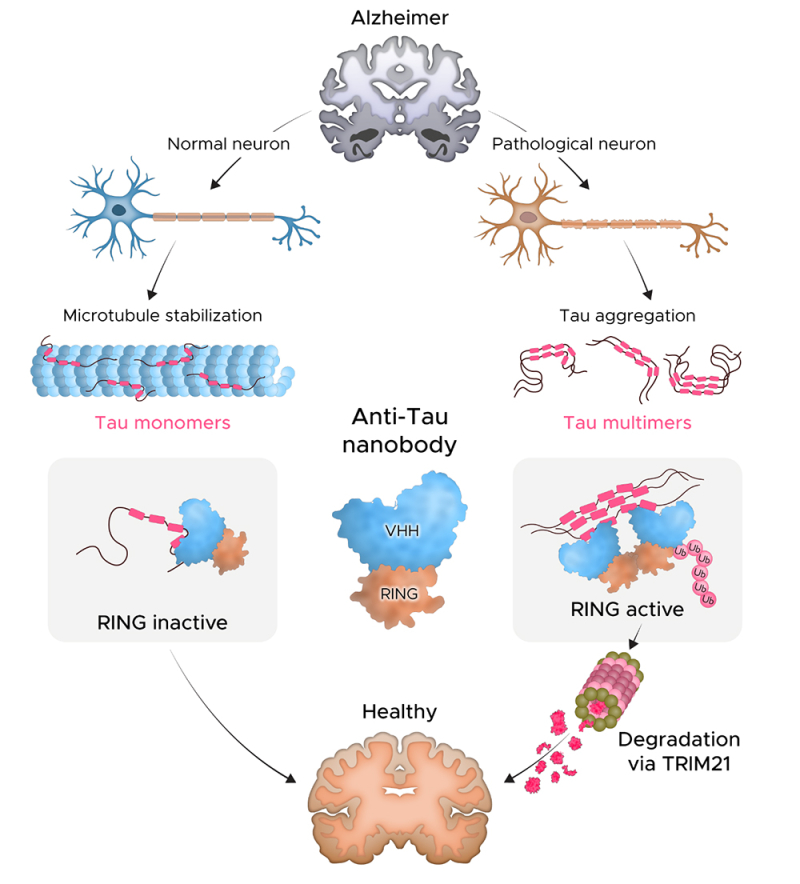
Figure : Sur la partie gauche, dans des conditions normales, dans un neurone : un assemblage moléculaire constitué d’un nanocorps (ou très petit anticorps) qui lie la protéine Tau et de la partie RING de la protéine TRIM21 n’est pas actif. La protéine Tau normale n’est pas modifiée et peut poursuivre son rôle de stabilisation des microtubules, contribuant ainsi au bon fonctionnement des neurones et du cerveau.
Partie droit, en conditions pathologiques dans un neurone : un assemblage moléculaire constitué d’un nanocorps qui lie la protéine Tau et de la partie appelée RING de la protéine TRIM21 est actif. En effet, il se fixe sur des protéines Tau sous forme agrégée, ce qui lui permet de rapprocher les domaines RING les uns des autres. Dans ce cas, la protéine tau est modifiée de manière à être reconnue comme une protéine à dégrader par la cellule et les agrégats sont détruits par le protéasome.
En savoir plus : et al. Aggregate-selective removal of pathological tau by clustering-activated degraders.Science385,1009-1016(2024).DOI:10.1126/science.adp5186
Contact
Laboratoires
Lille Neuroscience & cognition - LilNcog (Inserm/Université de Lille)
Bâtiment Biserte,
Rue Polonovski
59045 Lille, France
Biologie structurale intégrative – BSI (CNRS/Inserm/Institut Pasteur de Lille/Université de Lille)
RID-AGE Risk factors and molecular determinants of ageing related diseases
Campus CNRS de la Haute Borne,
50 Avenue de Halley,
59658 Villeneuve d’Ascq
Dementia Research Institute (University of Cambridge)
Cambridge, UK