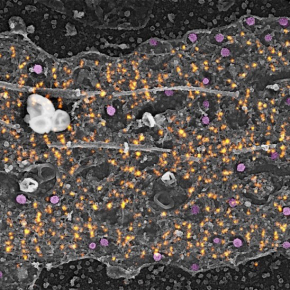
Des nano-clairières pour permettre l’endocytose le long de l’axone
L'endocytose est un mécanisme qui permet le transport de molécules vers l’intérieur de la cellule. Ce mécanisme est fondamental pour le fonctionnement des neurones. Dans un article publié dans la revue Science, les scientifiques décrivent de nouvelles structures, qu’ils nomment « clairières », le long du segment initial de l'axone et qui permettent une endocytose « à la demande » sous l'effet de stimuli physiologiques.
L’endocytose le long de l’axone
L'endocytose dans les neurones est principalement médiée par l'assemblage de puits recouverts de clathrine, une protéine structurelle qui constitue l’enveloppe de certaines vésicules et qui permet l’invagination de la membrane plasmique et la formation de vésicules d’endocytose. Dans les neurones, ces puits sont nombreux dans le corps cellulaire et les dendrites ainsi qu'autour de la zone active dans les présynapses, structure du neurone qui permet la communication nerveuse. En revanche, l'organisation nanoscopique ou la présence d’endocytose médiée par la clathrine le long de l'axone, la partie du neurone qui transmet les signaux électriques vers les cellules cibles, est peu connue, en particulier au niveau du segment initial de l'axone, un compartiment spécialisé situé au début de l'axone. Il était classiquement admis que l'endocytose le long de l'axone était minimale, une hypothèse confortée par la présence d'un complexe dense de spectrines, d'ankyrines et de protéines membranaires ancrées au niveau du segment initial, avec la présence d’un échafaudage périodique d’anneaux d'actine reliés par des spectrines le long de la membrane plasmique.
Mise en évidence de « clairières » qui permettent la formation de puits de clathrine le long de l’axone
Dans un article publié dans la revue Science, les scientifiques ont combiné la microscopie de super-résolution et électronique pour révéler la nano-architecture des puits de clathrine au niveau du segment initial et leur activité d'endocytose. En plus de l'échafaudage périodique, les spectrines forment avec l'actine des zones d'exclusion circulaires bien définies qu’ils ont appelées « clairières », qui permettent aux puits de clathrine de se former en leur centre, au contact de la membrane plasmique. En manipulant génétiquement des cultures de neurones ou en les traitant avec des substances ciblant l'actine ou le réseau de spectrine, ils ont découvert que le réseau dense de spectrine limite la formation de puits en définissant ces clairières. Les puits de clathrine contenus dans les clairières du segment initial ont une stabilité inhabituelle, ce qui restreint l'endocytose au niveau du segment initial des neurones au repos. Ces puits immobilisés peuvent être « débloqués » et l'endocytose déclenchée au niveau du segment initial par une stimulation avec le N-méthyl-D-aspartate (NMDA). Ce déclenchement de l'endocytose est médié par la polymérisation de « nids » d'actine branchée au sein des clairières de spectrine, autour des CCP, nids qui aident à détacher les puits de clathrine de la membrane plasmique.
L’endocytose est régulée grâce à ces clairières au niveau du segment initial de l’axone
Cette étude à l'échelle nanométrique révèle que l'endocytose au niveau du segment initial de l’axone est régulée à deux niveaux. Tout d'abord, le maillage dense de spectrine limite la formation de puits de clathrine à l'intérieur de clairières circulaires où ils sont stabilisés, ce qui se traduit par une faible activité d'endocytose à l'état d'équilibre. Deuxièmement, l'endocytose à partir de ces puits préformés peut être déclenchée par des signaux physiologiques. Ces deux niveaux de régulation expliquent comment l'endocytose est régulée au sein de l'échafaudage stable de l’axone mature, permettant son réarrangement structurel et la régulation de l’excitabilité neuronale.
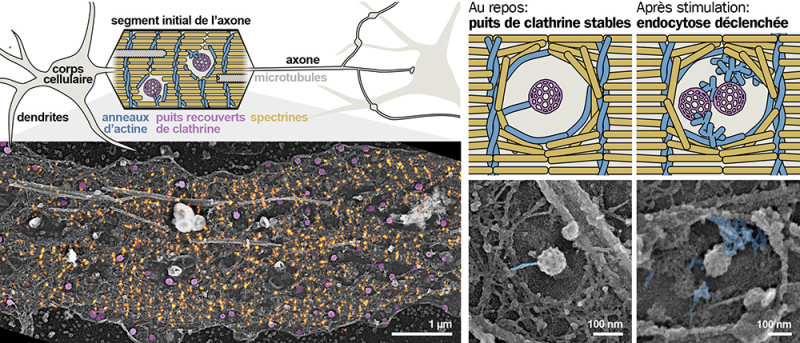
Figure : Nanoscopie des puits recouverts de clathrine et de l'endocytose au segment initial de l’axone. Le long du segment initial de l’axone (en haut à gauche), des puits recouverts de clathrine (en magenta sur la vue corrélative super-résolution STORM/microscopie électronique PREM, en bas à gauche) se forment dans les clairières de l'échafaudage périodique de spectrine (en orange). L'endocytose de ces puits stables à l'intérieur des clairières est déclenchée après une stimulation par le NMDA via la polymérisation de nids d'actine ramifiés (en bleu sur les images en microscopie électronique et les schémas, à droite).
En savoir plus : The actin-spectrin submembrane scaffold restricts endocytosis along proximal axons. Florian Wernert*, Satish Babu Moparthi*, Florence Pelletier, Jeanne Lainé, Gilles Moulay, Eline Simons, Fanny Boroni-Rueda, Nicolas Jullien, Sofia Benkhelifa-Ziyat, Marie-Jeanne Papandréou, Christophe Leterrier°, Stéphane Vassilopoulos°. Science. https://doi.org/10.1126/science.ado2032
Contact
Laboratoires
Institut de neurophysiopathologie – INP (CNRS/Aix Marseille Université)
27 boulevard Jean Moulin,
13005 Marseille
Institut de myologie (AP-HP/CEA/CNRS/Inserm/Sorbonne Université)
47 boulevard de l'hôpital,
75013 Paris