Une nouvelle cible thérapeutique dans les cancers mésenchymateux pédiatriques
Dans un article publié dans la revue EMBO Molecular Medicine, des scientifiques ont caractérisé une protéine appelée DiPRO1 qui favorise la croissance des cancers mésenchymateux chez l’enfant. L’inhibition de DiPRO1 induit la mort des cellules cancéreuses, alors qu’elle favorise la différenciation de myoblastes sains.
Contrairement aux adultes, les enfants, ont de nombreuses cellules qui prolifèrent au cours de leur croissance. En conséquence, les traitements par chimiothérapie,et/ou radiothérapie induisent des lésions importantes pouvant provoquer des séquelles graves, parfois mortelles. Il existe donc un besoin crucial de nouvelles thérapies moins toxiques.
DiPRO1, une protéine surexprimée dans certains cancers mésenchymateux de l’enfant.
Des travaux précédents avaient permis de montrer que la protéine DiPRO1 jouait un rôle important dans le contrôle de la prolifération, de la différenciation cellulaire et la mort cellulaire programmée (apoptose).
DiPRO1 partage des cibles avec une autre protéine, SIX1, qui est un régulateur important du développement musculaire. Elle est par ailleurs surexprimée dans les rhabdomyosarcomes pédiatriques et les sarcomes d'Ewing, deux cancers mésenchymateux, Ces niveaux importants de DiPRO1 sont liés à des tumeurs récurrentes, ce qui suggère qu'il s'agit d'un marqueur pronostique potentiel. Dans l’étude publiée dans la revue EMBO Molecular Medicine, les scientifiques ont comparé in vitro les effets de la surexpression ou de la perte d’expression de la protéine DiPRO1 dans des myoblastes sains et des cellules mésenchymateuses cancéreuses. Dans les deux types de cellules, ils ont découvert que DiPRO1 joue un double rôle dans la régulation des gènes et la modification de l'ADN. Il peut agir en tant que répresseur ou activateur de l’expression de nombreux gènes, jouant ainsi un rôle clé dans la reprogrammation du destin cellulaire.
Les résultats montrent que la protéine DiPRO1 joue des rôles distincts dans les cellules saines et dans les cellules cancéreuses. Dans les cellules musculaires saines, DiPRO1 aide à contrôler les gènes qui sont importants pour la croissance musculaire, les empêchant de se transformer en cellules musculaires pleinement développées.
Le rôle de DiPRO1 dans les cancers mésenchymateux est particulièrement intéressant. L’inhibition de son expression est toxique pour la cellule cancéreuse et conduit à la mort cellulaire.
DiPRO1, une cible potentielle pour de futurs traitements.
Les cancers d'origine mésenchymateuse partagent des mécanismes communs impliquant DiPRO1. En conséquence, le ciblage de DiPRO1 pourrait constituer une nouvelle stratégie pour le traitement de ces cancers. Une première étude, utilisant un modèle souris dans lequel il est possible de greffer des tumeurs d’origine humaine, montre que l’utilisation de nanomédicaments pour cibler DiPRO1 provoque une inhibition significative de la croissance des cellules tumorales.
Comme la déplétion de DiPRO1 dans les cellules normales n'induit pas la mort cellulaire, on dispose ainsi d’une possibilité de traiter spécifiquement les cellules cancéreuses. Cette action sélective représente une approche potentiellement moins toxique pour traiter les patients qui souffrent d'effets tardifs importants de leurs traitements anticancéreux actuels
Des recherches sur des inhibiteurs de DiPRO1, pourraient conduire à des traitements moins nocifs et peut être plus efficaces.
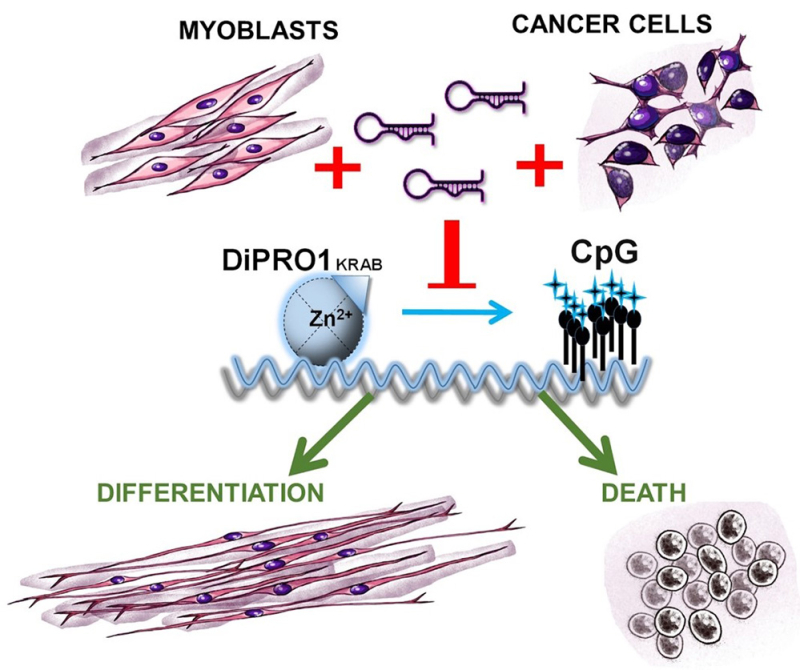
Figure : L'inhibition de DiPRO1 induit l’activation épigénétique des îlots CpG, favorisant la myogenèse dans les myoblastes tout en conduisant à l'apoptose dans les cellules de rhabdomyosarcome et de sarcome d'Éwing. Cibler DiPRO1 avec des nanomédicaments si/shDiPRO1 représente une voie de traitement potentielle pour les cancers mésenchymateux.
Pour en savoir plus :
DiPRO1 distinctly reprograms muscle and mesenchymal cancer cells, Rich J, Bennaroch M, Notel L, Patalakh P Alberola J, Issa F, Opolon P, Bawa O, Rondof W, Marchais A, Dessen Ph, Meurice G, Le-Gall M, Porlot M, Ser-Le Roux K, Droin N, Raslova H, Maire P, Geoerger B, and Pirozhkova I.
EMBO Molecular Medicine, , DOI : 110.1038/S44321-024-00097-Z
Contact
Laboratoire
Institut Cochin (CNRS/Inserm/Université Paris-Cité)
24 Rue du Faubourg Saint-Jacques
75014 Paris - France
