Myélome multiple : mieux comprendre les résistances au traitement pour les contourner
Dans le myélome multiple, un cancer du sang, l’inactivation, même partielle, d’un gène appelé TP53 est associée à la résistance et à l’échappement aux traitements. Dans une étude publiée dans la revue Blood, les scientifiques ont inactivé le gène TP53 dans des cellules de myélome en culture afin de mieux comprendre les conséquences fonctionnelles de cette perte de fonction. Leurs résultats ouvrent la voie à de nouveaux traitements.
La perte du gène TP53 qui code pour la protéine p53 est un évènement majeur dans le développement et la progression des cancers. En effet, p53, également appelée « gardien du génome », est un facteur de transcription bien connu aujourd’hui pour son rôle crucial dans la suppression tumorale. Le myélome multiple est une tumeur qui affecte un type de cellules du système immunitaire, les plasmocytes, disséminés dans la moelle osseuse. Ce cancer, qui touche 5000 nouvelles personnes par an en France, reste encore difficile à guérir. La perte de p53 est associée à une forte résistance aux traitements, entravant toute rémission complète malgré les avancées thérapeutiques apportées par l’immunothérapie. Pour mieux comprendre son impact, les scientifiques ont reproduit cette perte de p53 dans des cellules de myélome.
L’inactivation de TP53 dans des cellules de myélome pour un meilleur diagnostic.
Grâce à la technologie CRISPR/Cas9, les scientifiques ont invalidé le gène TP53 dans deux lignées de cellules de myélome, découvrant ainsi les gènes dont l’expression est affectée par cette modification. Parmi eux, 13 ont été sélectionnés pour établir une signature spécifique de p53 et construire un score fonctionnel qui définit le niveau d’expression de ces 13 gènes mesurant ainsi l'activité de p53. Celui-ci s’est avéré particulièrement efficace pour différencier les cellules en fonction du statut de TP53 (présent, absent ou muté) dans les lignées de myélome, ainsi que dans plus de 1000 lignées cellulaires issues de tous types de cancers. Ce score est apparu être un outil efficace pour détecter une invalidation totale de TP53 dans chaque cellule de chaque tumeur et pouvoir ainsi anticiper les risques pour chaque patient de ne pas répondre aux traitements (Brevet INSERM/CNRS/Nantes Université).
Mise en évidence d’un facteur clé dans la réponse thérapeutique : le gène BAX
Parmi les gènes du score, les scientifiques ont découvert que l’expression du gène BAX, régulé par p53, joue un rôle crucial dans la réponse des cellules à une petite molécule de thérapie ciblée qui vise la protéine MCL1, le BH3 mimétique S63845. Les protéines BAX et MCL1 appartiennent toutes les deux à la famille BCL2 qui régule l'équilibre entre la survie et la mort cellulaire programmée, appelée apoptose. Alors que BAX est un exécuteur de la mort cellulaire (protéine pro-apoptotique), MCL1, au contraire l’empêche (protéine anti-apoptotique) en séquestrant les protéines pro-apoptotiques. L'objectif du BH3 mimétique est de libérer ces protéines pro-apoptotiques en se fixant à MCL1, afin de déclencher l’apoptose. Cependant, lorsque l'expression de BAX est réduite suite à la perte de p53, la quantité de BAX associé à MCL1 diminue également et les cellules de myélome deviennent plus résistantes à ce traitement.
Surpasser la résistance à la mort cellulaire en adaptant les traitements.
Les scientifiques ont démontré qu'il était possible de surmonter la résistance au S63845 en combinant plusieurs BH3 mimétiques ciblant simultanément MCL1 et une autre protéine anti-apoptotique nommée BCL2. Cette approche combinée a montré une efficacité remarquable dans la quasi-totalité des 70 échantillons de patients atteints de myélome testés, et ce, indépendamment du statut de TP53. Ainsi, cette combinaison pourrait représenter une stratégie particulièrement prometteuse pour les patients présentant une invalidation totale de TP53 pour lesquels le développement de nouvelles thérapies reste crucial.
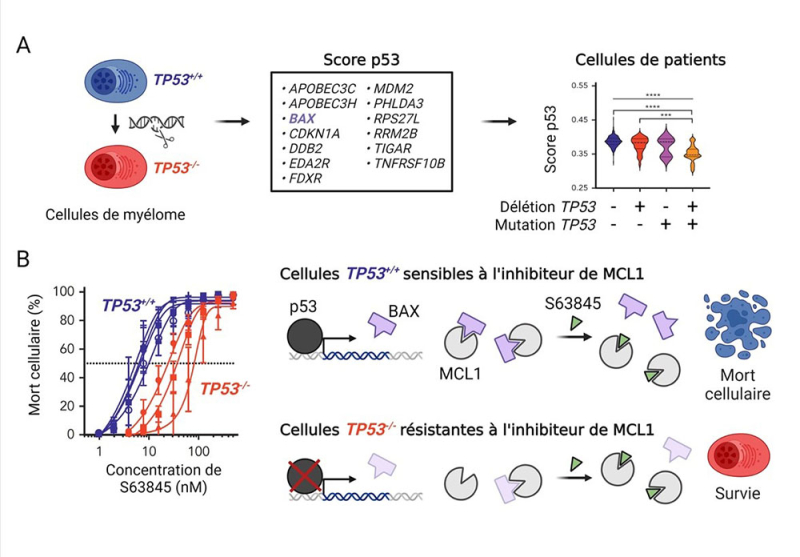
Figure : (A) Le gène TP53 a été inactivé dans des cellules de myélome par CRISPR-Cas9. La comparaison des profils d’expression génique des cellules avec et sans TP53 a permis d’identifier des gènes affectés par cette modification. Treize d’entre eux ont été sélectionnés pour calculer un score p53 permettant de discriminer les cellules de patients selon le statut de TP53 (délété et/ou muté).
(B) Les cellules inactivées pour TP53 (TP53-/-) sont plus résistantes à l’inhibiteur de MCL1, le S63845, que les cellules TP53 sauvage (TP53+/+). Dans les cellules TP53+/+, p53 induit l’expression de BAX permettant la formation de complexes MCL1-BAX. Le traitement au S63845 entraine alors une libération de BAX qui induit la mort cellulaire. Toutefois, dans les cellules TP53-/-, l’expression de BAX est diminuée en raison de l’absence de p53, ce qui réduit la quantité de complexes MCL1-BAX et entraîne ainsi une résistance des cellules au S63845.
Référence : Durand R, Descamps G, Bellanger C, Dousset C, Maïga S, Alberge JB, Derrien J, Cruard J, Minvielle S, Lilli NL, Godon C, Le Bris Y, Tessoulin B, Amiot M, Gomez-Bougie P, Touzeau C, Moreau P, Chiron D, Moreau-Aubry A, Pellat-Deceunynck C. A p53 score derived from TP53 CRISPR/Cas9 HMCLs predicts survival and reveals a major role of BAX in the response to BH3 mimetics. Blood. 2024 Mar 28;143(13):1242-1258. doi: 10.1182/blood.2023021581. PMID: 38096363.
doi: 10.1182/blood.2023021581.
Contact
Laboratoire
Centre de recherche en cancérologie et immunologie intégrée Nantes Angers (CRCI2NA)
8 quai Moncousu
44007 Nantes
