Schizophrénie, Alzheimer : une potentielle nouvelle classe d’agent thérapeutiques qui cible les récepteurs nicotiniques
Une classe particulière des récepteurs nicotiniques du cortex est impliquée dans les fonctions cognitives supérieures. Ces fonctions telles que la mémoire, le langage ou les fonctions exécutives sont altérées par des maladies comme la schizophrénie ou Alzheimer. Dans une étude publiée dans Nature Communications, des scientifiques ont pu décrire le mécanisme d’action de molécules qui, non content de stimuler efficacement ces récepteurs nicotiniques, parviennent aussi à les cibler avec précision. Ces agents, à potentiel thérapeutique, sont les d’anticorps monochaine d’alpagas. Grâce à ces résultats, les scientifiques ont des informations précieuses pour ouvrir de nouvelles options thérapeutiques dans le traitement de maladies neurodéveloppementales et psychiatriques.
Diverses pathologies neurodéveloppementales et psychiatriques telles que la maladie d’Alzheimer ou la schizophrénie sont associées à des déficits cognitifs majeurs, et de nombreuses études académiques et industrielles cherchent à développer des molécules pro-cognitives. Dans ce cadre, les recherches se sont intéressées aux récepteurs nicotiniques de l’acétylcholine qui assurent la communication entre les neurones, et sont impliqués dans de nombreuses fonctions essentielles au bon fonctionnement de notre cerveau. Parmi les récepteurs nicotiniques, les récepteurs de type alpha7 sont exprimés dans le cortex et l’hippocampe et médient les fonctions cognitives supérieures. De nombreuses petites molécules augmentant l’activité du récepteur alpha7 ont été développés, mais à ce jour aucune n’a franchi les phases cliniques pour une mise sur le marché d’un médicament, en particulier due à leur manque de spécificité pour la cible thérapeutique en question, le sous-type alpha7.
Dans un travail publié dans la revue Nature Communication, des scientifiques ont décrypté le mécanisme d’action des anticorps monochaine de camélides qui augmentent la réponse des récepteurs alpha7 à l’acétylcholine. Cette dernière est un neurotransmetteur qui joue un rôle central dans la communication synaptique entre les neurones dans le système nerveux central et périphérique. Ces anticorps, générés par la stimulation du système immunitaire d’alpagas, sont des petites protéines hautement spécifiques pour le récepteur alpha7 et constituent une nouvelle classe d’agents pro-cognitifs prometteuse.
Un mécanisme moléculaire inédit pour intervenir pharmacologiquement sur la fonction du récepteur
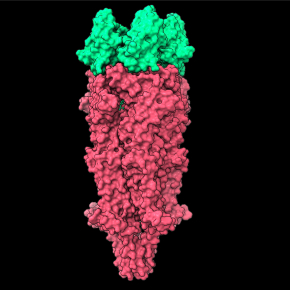
Les scientifiques ont ainsi décrit plusieurs structures de complexes entre le récepteur alpha7 et deux anticorps par cryo-microscopie électronique en particule unique. Elles montrent à résolution atomique la région de la protéine ciblée par les anticorps, qui est situé à l’apex de la protéine, pour faciliter à distance l’action du neurotransmetteur endogène, l’acétylcholine. Les données montrent aussi un mode unique d’interaction où les anticorps s’assemblent en pentamère, la liaison totale de cinq anticorps permettant à elle seule d’activer les récepteurs en l’absence de neurotransmetteur. Ainsi, elles révèlent à haute résolution à la fois l’épitope ciblé (la cible de l’anticorps) et un mécanisme moléculaire inédit pour intervenir pharmacologiquement sur la fonction du récepteur.
Ces résultats établissent les bases structurales pour le développement d’une nouvelle classe d’agent pharmacologiques de haute spécificité et affinité. Les structures seront essentielles pour l’ingénierie de ces anticorps, en particulier dans le but de faciliter leur passage de la barrière hémato-encéphalique, pour in fine investiguer leur pouvoir pro-cognitive dans les modèles animaux pré-cliniques.

Figure : structure du récepteur nicotinique de l’acétylcholine alpha7 (marron) en complexe avec un ou cinq nanobodies (vert). La membrane dans laquelle le récepteur est enchâssé est également représentée. Les données montrent que le nanobody se lie à l’apex du récepteur, et que la liaison de cinq nanobodies permet l’activation du récepteur en l’absence de neurotransmetteur.
En savoir plus :
An original potentiating mechanism revealed by the cryoEM structures of the human α7 nicotinic receptor in complex with nanobodies.
Prevost MS, Barilone N, Dejean De La Batie G, Pons S, Ayme G, England P, Gielen M, Bontems F, Pehau-Arnaudet G, Maskos U, Lafaye P, Corringer PJ
Nature Communications, 25 septembre 2023, DOI : https://doi.org/10.1038/s41467-023-41734-4
Contact
Laboratoire
Gènes, synapses et cognition - UMR3571 (CNRS / Institut Pasteur)
Bâtiment Biotechnologies
25 rue du Docteur Roux
75724 Paris CEDEX 15