Une extrémité virale inédite a été identifiée chez les ARN de deux virus associés à la maladie du court-noué de la vigne
La maladie du court-noué de la vigne entraîne des pertes massives de rendement pour l’industrie viticole mondiale. Cette maladie incurable est majoritairement causée par deux virus : le grapevine fanleaf virus (GFLV) et de l’arabis mosaic virus (ArMV). Dans cette étude publiée dans Plant Physiology, les scientifiques mettent en évidence une extrémité 3’ inédite à la fin des ARN de ces deux virus. Cette découverte ouvre des perspectives nouvelles pour l’étude du métabolisme de ces ARN viraux et ainsi imaginer des traitements spécifiques.
Les plantes, et particulièrement les espèces cultivées, sont régulièrement confrontées à des infections par des virus. Ces infections virales sont responsables de pertes de rendement agricole conséquentes à l’échelle mondiale. Parmi les virus infectant les plantes, un grand nombre possède un génome constitué d’ARN simple brin de polarité positive ou ss(+). Ces ARN viraux ss(+) sont répertoriés en deux groupes principaux en fonction de leurs extrémités 3’: les ARN se terminant par une succession d’adénosines ou ARN viraux polyadénylés, et les ARN viraux non-polyadénylés. Les régions 3’ de ces derniers se replient en structures parfois complexes, ressemblant pour certaines à des ARN de transfert (tRNA-like).
Dans cette étude, un nouveau type d’extrémité 3’ d’ARN viral a été décrit par les scientifiques. Pour réaliser cette découverte, ils ont, en utilisant une approche de séquençage à haut débit, cartographié précisément les extrémités 3’ de 47 ARN issus de virus couvrant le large spectre des virus à ARN ss(+) infectant les plantes. Cette analyse systématique révèle notamment que les extrémités 3’ des ARN viraux, polyadénylés et non-polyadénylés, sont fréquemment modifiées par l’ajout d’uridines, un processus appelé uridylation. Deux enzymes des plantes hôtes catalysent ce mécanisme de manière différentielle. Ainsi, les taux d’uridylation et la position des sites d’uridylation renseignent sur les mécanismes de dégradation des ARN viraux. De manière fortuite, les scientifiques ont également découvert que les deux ARN du grapevine fanleaf virus (GFLV) et de l’arabis mosaic virus (ArMV) se terminent par une succession d’adénosines suivie presque systématiquement d’une uridine unique. Cette mono-uridylation semble indépendante des enzymes de la plante hôte. La séquence (A)nU, qui correspond à un nouveau type d’extrémité 3’ virale, est spécifique du GFLV et de l’ArMV car elle n’est pas retrouvée chez d’autres virus à ARN ss(+), y compris ceux appartenant au genre des Nepovirus de la famille des Secoviridae, auxquels appartiennent le GFLV et l’ArMV. Cette découverte ouvre des perspectives nouvelles d’étude du métabolisme des ARN du GFLV et de l’ArMV, et notamment de la spécificité de leur mécanisme de réplication. Ces connaissances pourraient permettre à terme d’élaborer des stratégies innovantes afin de combattre ces deux virus, agents principaux de la maladie du court-noué de la vigne et responsables de pertes importantes pour l’industrie viticole mondiale.
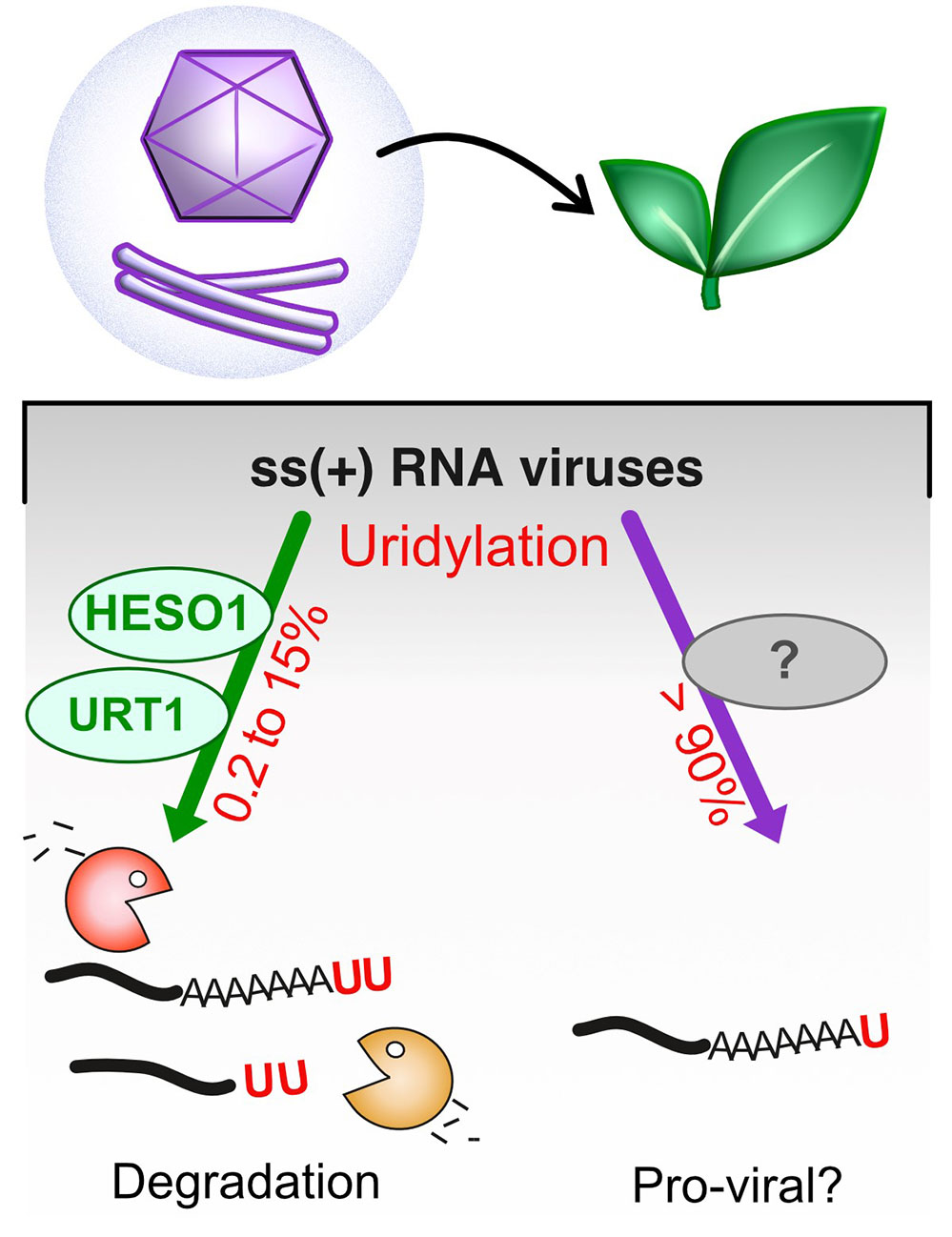
Figure : Les ARN viraux des plantes sont uridylés à différents niveaux et les profils spécifiques au virus indiquent des fonctions anti- et pro-virales potentielles. La plupart des ARN viraux testés sont uridylés à des niveaux variant de 0.2 à 15% par deux enzymes de l’hôte, UTP:RNA URIDYLYLTRANSFERASE1 (URT1) et HEN1 SUPPRESSOR1 (HESO1). Cette uridylation pourrait participer à l’élimination des ARN viraux. D’autres ARN viraux sont uridylés à des niveaux supérieurs à 90% par des enzymes encore inconnues. Ce deuxième type d’uridylation, massive, pourrait jouer un rôle pro-viral.
Pour en savoir plus :
An extensive survey of phytoviral RNA 3’ uridylation identifies extreme variations and virus-specific patterns
Anne Caroline Joly1, Shahinez Garcia2, Jean-Michel Hily2,3, Sandrine Koechler1, Gérard Demangeat2, Damien Garcia1, Emmanuelle Vigne2, Olivier Lemaire2, Hélène Zuber1,* and Dominique Gagliardi1,*
Plant Physiology, kiad278, https://doi.org/10.1093/plphys/kiad278
Publication le 13 mai 2023
Online ahead of print.
Contact
Laboratoires
Institut de biologie moléculaire des plantes - IBMP (CNRS / Université de Strasbourg)
12, rue du général Zimmer
67084 Strasbourg
Santé de la Vigne et Qualité du Vin – SVQV (INRAE / Université de Strasbourg)
Centre Grand Est-Colmar
28 rue de Herrlisheim
68000 Colmar
