La microscopie électronique pour décrire l’évolution des moteurs moléculaires
Dans un article publié dans la revue Nature Communications, les scientifiques apportent une connaissance nouvelle concernant les mécanismes moléculaires de production de force et de mouvement au sein des cellules.
Les myosines sont des protéines essentielles au maintien de nombreuses fonctions biologiques telles que la contraction musculaire, le déplacement ou encore le trafic cellulaire. On dénombre aujourd’hui trente-cinq classes de myosine qui divergent à la fois par leur fonction et leur localisation cellulaire. Ces protéines sont aussi associées à diverses maladies: myopathies, surdité, cancers et parasitoses telles que la malaria.
Toutes les myosines sont des moteurs moléculaires qui s’associent aux filaments d’actine, elles convertissent l’énergie chimique contenue dans l’adénosine triphosphate (ATP) en force ou en mouvement (énergie mécanique). Dans les muscles, la formation du complexe actomyosine et la consommation d’ATP fait glisser le filament d’actine, provoquant ainsi la contraction musculaire. La compréhension de l’interaction entre la myosine et le filament d’actine est donc fondamentale pour comprendre le mécanisme d’action des myosines. Comme l’actine est de nature filamenteuse, l’étude du complexe actomyosine est un défi technique et les interactions moléculaires précises entre l’actine et la myosines sont débattues depuis plus de trente ans. Les récentes avancées techniques en cryo-microscopie électronique (cryoEM) permettent aujourd’hui de résoudre des structures de complexes actomyosine à plus haute-résolution et donc d’étudier l’interface en détail.
Les scientifiques ont résolu la structure du complexe actomyosine de Plasmodium falciparum, le parasite responsable du paludisme, à haute-résolution par cryoEM. Ce complexe est très intéressant car à la fois l’actine et la myosine de P. falciparum sont divergentes par rapport à leurs homologues présents chez les mammifères ou même les invertébrés qui ont été étudiés jusqu’alors. L’étude comparée de ce complexe actomyosine avec les structures d’autres complexes résolus récemment a permis de montrer que l’interface entre l’actine et la myosine peut être divisée en deux régions distinctes : une interface centrale conservée et une interface auxiliaire spécifique à chaque famille de myosine. Ces résultats mettent en lumière comment l’interface auxiliaire a évolué dans les différentes classes de myosines afin de leur permettre d’assurer leurs fonctions spécifiques.
Ces travaux apportent une compréhension nouvelle de la manière dont la force et le mouvement sont produits dans les cellules. Ils permettent de mettre en lumière comment les différentes classes de myosine ont, au cours de l’évolution, conservé une interface centrale avec l’actine mais développé des spécificités propres à leur fonction. Ils permettront une meilleure connaissance des moteurs moléculaires et de leurs mécanismes d’action et pourraient ouvrir des pistes pour de nouveaux composés antipaludiques ciblant la myosine de P. falciparum.
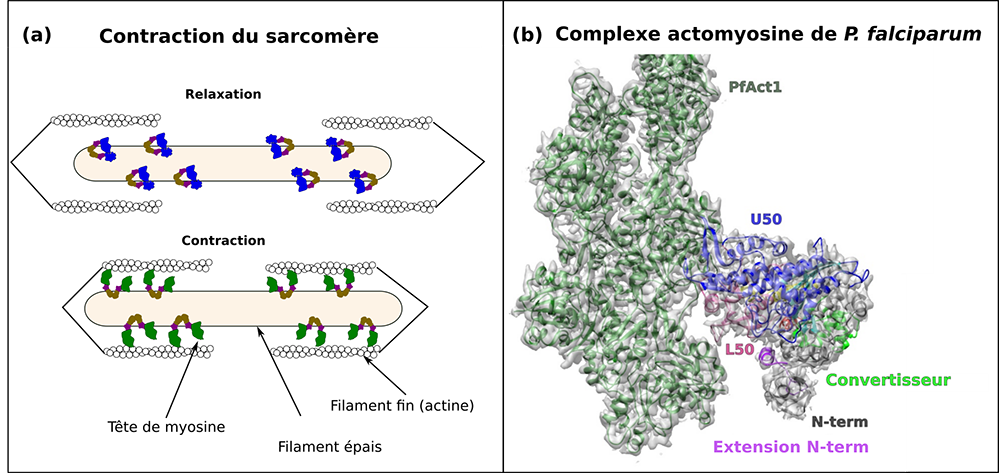
Figure : structure et fonction du complexe actomyosine. (a) représentation schématique du sarcomère, l’unité fondamentale du muscle. Pendant la relaxation, les têtes de myosine (filament épais) n’interagissent pas avec les filaments d’actine (filaments fins). L’interaction des têtes de myosine avec l’actine permet un glissement des filaments d’actine et donc un raccourcissement du sarcomère qui mène à la contraction musculaire. (b) Structure à haute-résolution du complexe de la myosine A (PfMyoA) et de l’actine 1 (PfAct1) de Plasmodium falciparum résolue par cryo-microscopie électronique à haute résolution. Les sous-domaines de la myosine sont colorés distinctement. Cette structure permet l’étude de l’interface du complexe actomyosine en détail.
Pour en savoir plus :
The actomyosin interface contains an evolutionary conserved core and an ancillary interface involved in specificity.
Robert-Paganin, J, Xu, XP, Swift, MF, Auguin D, Robblee J, Lu H, Fagnant PM, Kremensova EB, Tribus KM, Houdusse A, Volkmann N, Hanein D.
Nat Communications. 25 mars 2021. https://doi.org/10.1038/s41467-021-22093-4
Contact
laboratoire
Biologie cellulaire et cancer (CNRS/Sorbonne Université)
Institut Curie
12 rue Lhomond 75005 Paris, France