Phosphorylation de SHARPIN et NF-?B : La marque à suivre
Le complexe d’ubiquitination LUBAC orchestre l’activation du facteur de transcription NF-kB, une étape décisive de la réponse immunitaire innée et adaptative. Cette étude, publiée dans la revue iScience, révèle que la phosphorylation de la sous-unité SHARPIN module l’activité de ce complexe et autorise l’activation optimale de NF-kB, un élément central dans l’immunité innée et adaptative. Ces résultats permettent d’envisager de nouvelles stratégies destinées à moduler l’action de ce complexe enzymatique.
L’ubiquitination est une modification post-traductionnelle impliquée dans la plupart des fonctions cellulaires chez les Eucaryotes. L’ubiquitination consiste en la liaison covalente d’ubiquitine, seule ou sous forme de chaînes, à un substrat. La topologie de ces chaînes fonctionne tel un véritable code et détermine la destinée des protéines ciblées. Le LUBAC (linear ubiquitin chain assembly complex), formé des enzymes HOIP et HOIL1 ainsi que de la protéine adaptatrice SHARPIN, catalyse la formation de chaînes d’ubiquitine atypiques dites « linéaires » et leur attachement spécifique à certains substrats. Le LUBAC gouverne notamment l’activation du facteur de transcription NF-kB en aval de la plupart des immunorécepteurs, assurant ainsi l’expression de gènes essentiels pour la mise en place de la réponse immune innée et adaptative. Toutefois, comment le LUBAC est régulé reste mal compris.
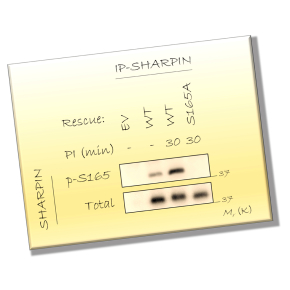
En analysant l’expression des composés du LUBAC dans des lymphocytes T humains et des lignées cellulaires d’origine lymphoïdes, les chercheurs ont découvert qu’une portion de SHARPIN est phosphorylée de manière constitutive. Des expériences de spectrométrie de masse associées à de la mutagénèse dirigée ont identifié la Sérine en position 165 comme principal site phospho-accepteur. La génération d’un anticorps monoclonal de souris dirigé contre SHARPIN phosphorylée sur ce site a permis de valider ces observations.
Afin d’évaluer l’impact de la phosphorylation de SHARPIN, des lymphocytes T immortalisés, dans lesquels l’expression de SHARPIN a été invalidée par la technologie CRISPR/Cas9, ont été reconstitués avec SHARPIN sauvage ou son mutant non phosphorylable. Des expériences de biochimie des protéines combinées à des analyses transcriptionnelles ont permis de montrer que la phosphorylation de SHARPIN sur la Sérine 165 permet l’activation optimale de NF-kB. D’un point de vue moléculaire, la phosphorylation de SHARPIN permet au LUBAC de décorer avec des chaînes d’ubiquitine, et ainsi d’activer correctement, une protéine essentielle à la signalisation NF-kB.
Ces résultats indiquent que la phosphorylation de SHARPIN contrôle de l’action du LUBAC et améliorent notre compréhension des mécanismes qui régulent l’activation de NF-kB.
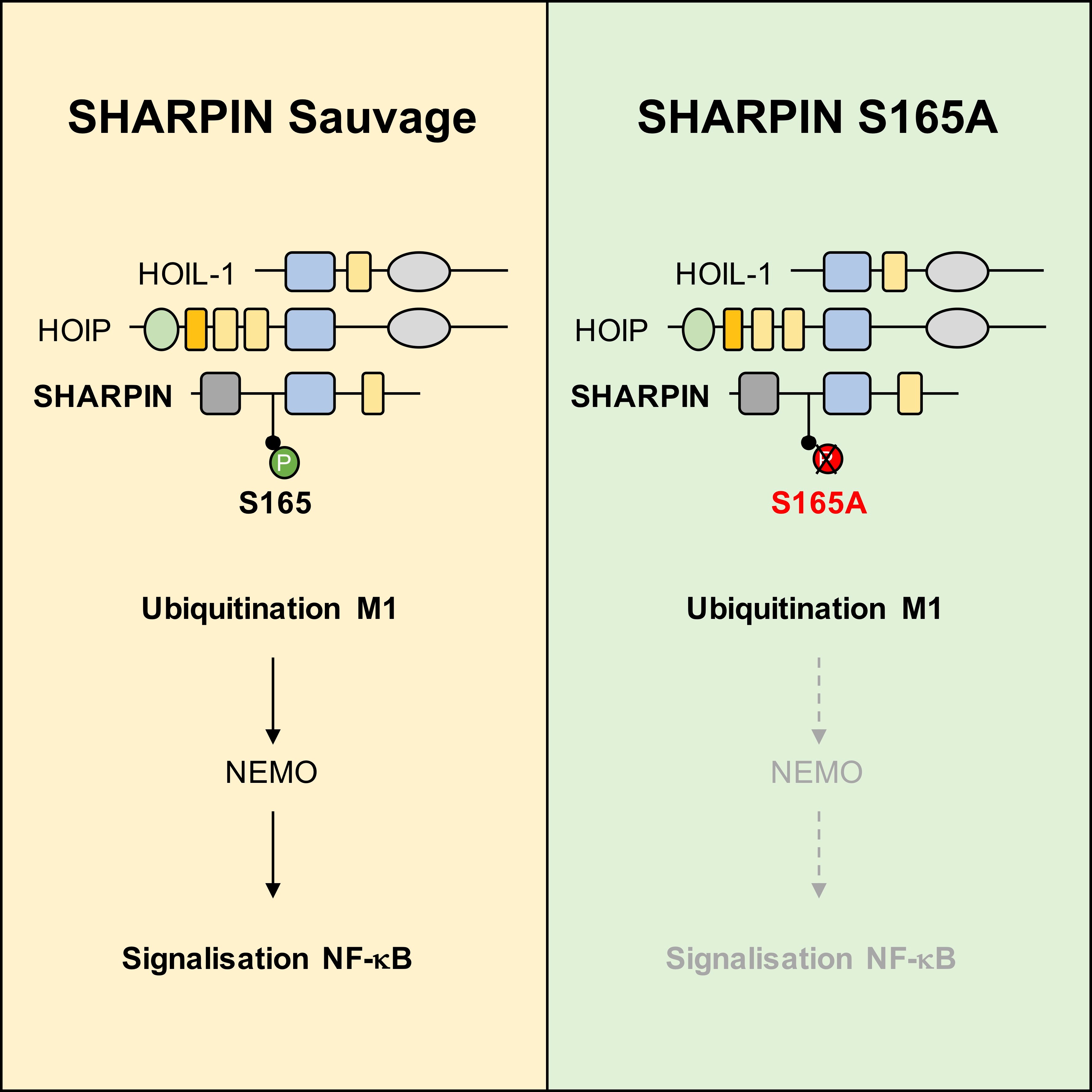
Figure : En réponse à l’engagement de multiples récepteurs du système immunitaire, le complexe d’ubiquitination linéaire LUBAC assemble et attache des chaînes d’ubiquitine linéaires sur la protéine NEMO. Cette modification coordonne l’activation optimale de la voie de signalisation NF-kB. Une portion de la sous-unité SHARPIN du LUBAC est constitutivement phosphorylée sur la Sérine 165 dans les cellules lymphoblastoïdes. Dans des cellules résistantes à cette modification, le LUBAC ne peut modifier correctement NEMO et l’activation de NF-kB est diminuée.
Pour en savoir plus :
Serine 165 Phosphorylation of SHARPIN regulates the Activation of NF-kB.
Thys A, Trillet K, Rosinska S, Gayraud A, Douanne T, Danger Y, Renaud CCN, Antigny L, Lavigne R, Pineau C, Com E, Vérité F, Gavard J, Bidère N.
iScience 13 Dec. 2020. doi: https://doi.org/10.1016/j.isci.2020.101939
Contact
Laboratoire
Centre de recherche en cancérologie et immunologie Nantes-Angers (CRCINA)(INSERM/CNRS/Université de Nantes)
Bâtiment IRS-UN
8 quai Moncousu
44000 Nantes