Une nouvelle piste pharmacologique dans le traitement de l'AVC
Un travail paru dans la revue J Cereb Blood Flow Metab (JCBFM) caractérise une nouvelle cible thérapeutique dans l’accident vasculaire cérébral (AVC). Ces données montrent que l'inhibition d'une enzyme liée à la voie de synthèse des polyamines réduit les dommages neuronaux et améliore la récupération fonctionnelle (motrice et cognitive) dans différents modèles d’AVC ischémique. Cette voie métabolique ayant fait l’objet de développement de modulateurs à visée thérapeutique dans d’autres pathologies, cette étude pourrait avoir un impact significatif sur l’orientation de la recherche vers de nouveaux médicaments dans l’AVC.
Personne n’est à l’abri de l’Accident Vasculaire Cérébral (AVC). Tenant en échec depuis des décennies la recherche biomédicale, l’AVC est une des maladies les plus dévastatrices au monde dont les séquelles peuvent mener à une lourde perte d’autonomie cognitive et motrice chez les patients voire au décès dans plus de 20% des cas. Les AVC restent la première cause de handicap chez l'adulte. En dehors des traitements thrombolytiques à l’emploi encore très limité, aucune molécule pharmacologique ne s'est jusqu'à présent révélée efficace en clinique, entraînant un exode des entreprises pharmaceutiques et de la recherche dans le domaine des AVC.
Aujourd'hui, plus que jamais, de nouveaux concepts et de nouvelles cibles sont nécessaires pour réengager la recherche sur l’AVC et accélérer le développement de nouveaux traitements anti-ischémiques.
Tirant parti de la conservation des mécanismes de protection cellulaire entre les espèces et les organes, au lieu d’une vision neurocentrique qui prévalait encore récemment, l’article publié dans la revue J Cereb Blood Flow Metab (JCBFM) caractérise une nouvelle cible anti-ischémique et son applicabilité dans des modèles d’AVC ischémiques in vitro et in vivo (1). Cette cible est située en aval de la voie de synthèse des polyamines qui génère la spermidine, un substrat nécessaire à l’activation (aussi nommée hypusination) du facteur d’initiation de la traduction eucaryote 5A (eIF5A). eIF5A est une protéine hautement conservée au cours de l'évolution, dont l’activation module la traduction de l’ARN et le métabolisme mitochondrial.
Les données montrent que l’inhibition de l’enzyme (la deoxyhypusine synthase ou DHPS) catalysant l’activation de eIF5a par un traitement pharmacologique avec un analogue des polyamines (le N1-guanyl-1,7-diaminoheptane), communément appelé GC7, permet d'atténuer fortement les conséquences délétères de l’ischémie induite par l’AVC sur le cerveau.
Dans différents modèles in vitro de cultures neuronales, le traitement au GC7 offre une protection des neurones contre le stress ischémique induits par des modèles de privation d’oxygène et de glucose, d’excitotoxicité et de stress oxydant. Par ailleurs, ces données in vitro identifient la préservation de la fonction mitochondriale et la prévention de la génération d’espèces oxydantes radicalaires toxiques (ROS) comme mécanismes majeurs de la protection par le CG7.
Afin d’étudier un potentiel intérêt clinique de cette découverte, les chercheurs ont étendu leurs travaux à un modèle d’AVC ischémique chez la souris. Les données démontrent que, même administrée après le déclenchement de l'AVC, dans une fenêtre temporelle compatible avec la prise en charge des patients victimes d’AVC, cette molécule aurait une double action permettant à la fois de réduire la lésion cérébrale mais aussi d’améliorer considérablement la récupération motrice et cognitive des animaux présentant un AVC.
Cette nouvelle cible thérapeutique ouvre donc des perspectives prometteuses pour le développement de stratégies pharmacologiques dans les pathologies ischémiques, dont l’AVC est l’exemple le plus dramatique. Son potentiel a d’ailleurs été confirmé avec succès sur la reprise fonctionnelle des reins dans un modèle préclinique de transplantation rénale chez le cochon, processus au cours duquel l’épisode ischémique est incontournable (2, 3).
Non seulement cette étude constitue une avancée conceptuelle dans la recherche de nouvelles cibles moléculaires contre l’AVC, mais elle a aussi un intérêt évident pour le monde pharmaceutique et les patients. En effet, si cette cible thérapeutique n'avait jamais été envisagée dans l’AVC, elle appartient à une voie déjà étudiée dans d’autres pathologies et a fait l’objet de développement de modulateurs pharmacologiques dont l’étude pourrait maintenant être envisagée dans la prévention et/ou le traitement de l’AVC.
Chez le rongeur, l’étude de la cognition se restreint en grande majorité à l’évaluation de l’apprentissage et de la mémoire, plus particulièrement la mémoire spatiale, une forme de mémoire déclarative. Pour évaluer l’effet du post-traitement avec le GC7 sur la récupération cognitive des animaux après un AVC, le test le plus couramment utilisé est celui de la piscine dite de « Morris ». Dans cette piscine qui est divisée en quatre cadrans égaux, une plate-forme est cachée sous une eau opaque. L’animal « apprend » en s’entrainant à retrouver la plateforme grâce aux indices visuels extérieurs placés autour de la piscine. Puis, pour évaluer la mémoire spatiale des animaux, 18 jours après l’AVC, les animaux sont de nouveau placés dans la piscine, où la plateforme a été retirée, et les profils de nage enregistrés traduisent directement la capacité de la souris à se rappeler de l’endroit où était placée la plateforme. En d’autres termes : si la souris se rappelle efficacement de la position de la plateforme, elle va effectuer une recherche circulaire ciblée dans cette zone et non pas une recherche aléatoire « tous azimuts ». Ici, la différence des profils de nage entre les souris traitées au Placebo et au GC7 indique donc clairement un effet bénéfique du traitement sur la capacité de mémorisation post-AVC des animaux.
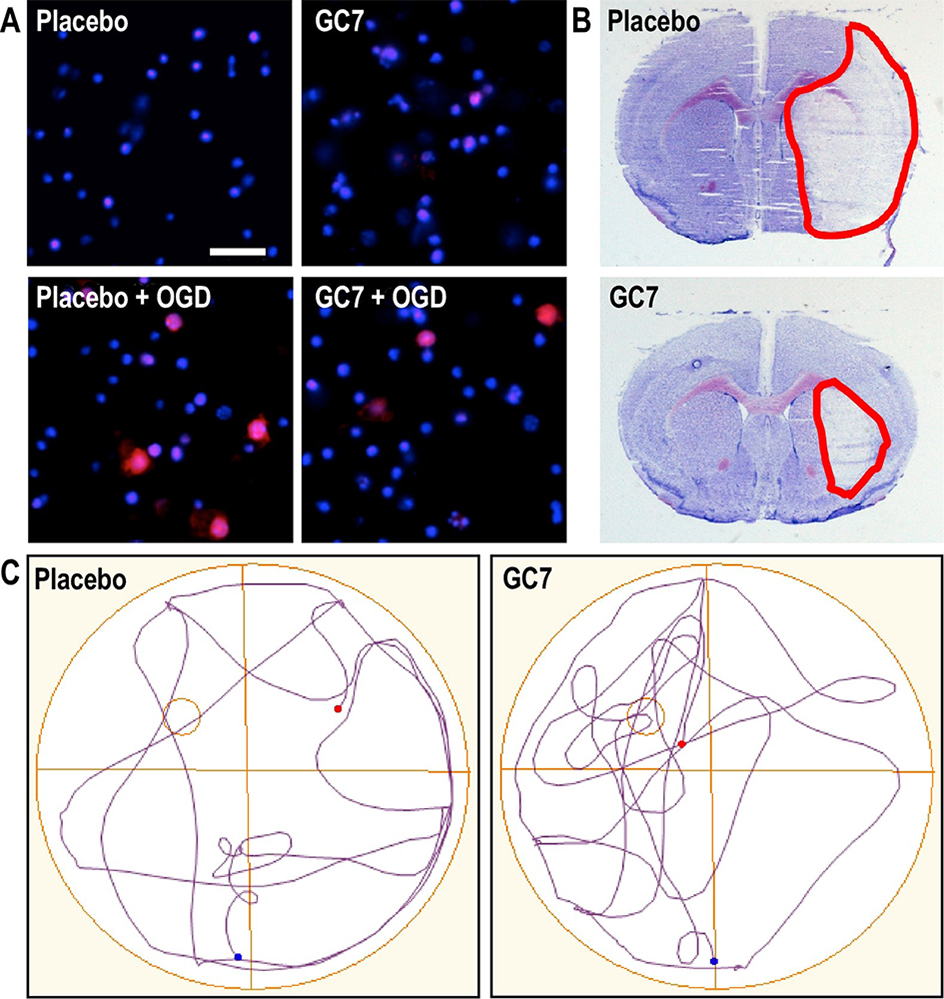
Figure : A : Le GC7 réduit la génération d’espèces réactives de l’oxygène (marquées en rouge) par la mitochondrie dans un modèle d’AVC in vitro par privation des neurones en oxygène et glucose.
B : Un traitement au GC7 réduit l’infarctus cérébral induit par un AVC focal (le tissu cérébral lésé est délimité en rouge).
C : les souris traitées au GC7 présentent une meilleure stratégie de recherche 18 jours après un AVC suggérant une meilleure récupération fonctionnelle (cognitive).
Pour en savoir plus:
1/ Inhibition of eIF5A hypusination pathway as a new pharmacological target for stroke therapy Bourourou M, Gouix E, Melis N, Friard J, Heurteaux C, Tauc M, Blondeau N..
J Cereb Blood Flow Metab 2 july 2020: https://doi.org/10.1177/0271678X20928882
2/ Targeting eIF5A Hypusination Prevents Anoxic Cell Death through Mitochondrial Silencing and Improves Kidney Transplant Outcome.
Melis N, Rubera I, Cougnon M, Giraud S, Mograbi B, Belaid A, Pisani DF, Huber SM, Lacas-Gervais S, Fragaki K, Blondeau N, Vigne P, Frelin C, Hauet T, Duranton C, Tauc M.
J Am Soc Nephrol. March 2017 doi: 10.1681/ASN.2016010012.
3/ The inhibition of eIF5A hypusination by GC7, a preconditioning protocol to prevent brain death-induced renal injuries in a preclinical porcine kidney transplantation model
Giraud S, Kerforne T , Zely J , Ameteau V , Couturier P , Tauc M , Hauet T.
Am J Transplant. 2020 May . DOI :13. 10.1111/ajt.15994.
Contact
Laboratoire
Institut de pharmacologie moléculaire et Cellulaire (IPMC) - (Université Côte d’Azur /CNRS)
660 route des Lucioles, Sophia Antipolis,
06560, Valbonne, France
Laboratoire de physiomédecine moléculaire (LP2M) - (Université Côte d’Azur/ CNRS)
Faculté de Médecine,
28 Avenue de Valombrose
06107 Nice cedex 2, France