L’addiction au chaperon chez les systèmes Toxine-Antitoxine
Chez les bactéries, certains systèmes toxine-antitoxine (poison-antidote) facilitent l’adaptation au stress ainsi que l’établissement des phénomènes de persistance et de tolérance aux antibiotiques. Des chercheurs du Laboratoire de microbiologie et génétique moléculaires au Centre de biologie intégrative et de l’Institut de pharmacologie et de biologie structurale ont identifié et caractérisé pour la première fois un module d’addiction à une protéine chaperon dans un système toxine-antitoxine de Mycobacterium tuberculosis. Ces travaux ont été publiés le 9 novembre 2016 dans la revue Nature Communications.
Chez les bactéries, les systèmes toxine-antitoxine sont des éléments clé de l’adaptation au stress et de la tolérance à certains antibiotiques. Il a été montré qu’en absence de stress, l’antitoxine se fixe à la toxine et la neutralise, protégeant ainsi la bactérie de l’effet délétère de la toxine. Par contre, en condition de stress, comme par exemple en présence de certains antibiotiques, l’antitoxine, moins stable, peut être rapidement dégradée par des protéases. La toxine ainsi libérée va pouvoir contrôler la croissance bactérienne en ciblant des fonctions cellulaires importantes, comme par exemple la réplication, la synthèse des protéines ou même la paroi bactérienne. Le ralentissement ou l’arrêt de croissance transitoire, induit par la toxine, peut faciliter la survie de la bactérie en attente de conditions plus favorables.
Mycobacterium tuberculosis, la bactérie responsable de la tuberculose, cause chaque année plus d’un million de décès dans le monde et constitue un problème majeur de santé publique. La virulence de cette bactérie est en partie associée à une sous-population bactérienne capable de s’adapter aux conditions défavorables (défense immunitaire de l’hôte ou traitements antibiotiques) en ralentissant significativement son métabolisme. Cet état de persistance permet aux bactéries de survivre jusqu’à ce que les conditions deviennent plus favorables à leur développement, comme lors de l’affaiblissement du système immunitaire de l’hôte par exemple.
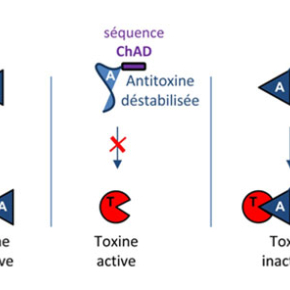
M. tuberculosis a la particularité de posséder de nombreux systèmes toxine-antitoxine, près de 80 systèmes, qui pourraient participer à l’établissement de la phase de persistance chez cette bactérie. Parmi ces systèmes, on retrouve un système toxine-antitoxine atypique, appelé TAC, qui est composé d’une toxine (HigB1), d’une antitoxine (HigA1) et d’un troisième partenaire : un chaperon moléculaire apparenté au chaperon SecB, connu pour être impliqué dans la sécrétion des protéines chez d’autres bactéries. Dans le cas de TAC, le chaperon contrôle spécifiquement le système toxine-antitoxine en interagissant spécifiquement avec l’antitoxine, facilitant son repliement et la protégeant de la dégradation par des protéases. En utilisant le système TAC de M. tuberculosis comme modèle d’étude, l’équipe de Pierre Genevaux au Laboratoire de Microbiologie et Génétique Moléculaires du Centre de Biologie Intégrative de Toulouse (CNRS, Université Paul Sabatier), en collaboration avec l’équipe de Lionel Mourey de l’Institut de Pharmacologie et de Biologie Structurale (CNRS, Université Paul Sabatier), vient d’identifier une nouvelle région présente à l’extrémité carboxy-terminale de l’antitoxine du système TAC qui recrute spécifiquement le chaperon et qui l’impose comme troisième partenaire indispensable au fonctionnement du cycle d’activation/inhibition de la toxine. En effet, en absence du chaperon, cette séquence, appelée « ChAD » (pour « chaperone-addiction » sequence), déstabilise l’antitoxine et l’empêche ainsi d’inhiber efficacement la toxine. Les chercheurs ont ensuite montré que la séquence ChAD de l’antitoxine et son chaperon dédié formaient un nouveau module d’addiction au chaperon qui pouvait être transféré à d’autres systèmes toxine-antitoxine « classiques » à deux composants, ou même à des protéines recombinantes non-apparentées. Ce nouveau couple « ChAD-Chaperon » pourrait être utilisé pour optimiser l’expression et le repliement de protéines recombinantes chez les bactéries hôtes à des fins biotechnologiques ou médicales.
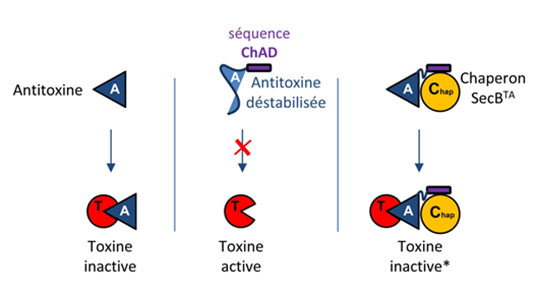
Figure : Mécanisme d’addiction au chaperon chez les systèmes toxine-antitoxine. Dans le cas d’un système toxine-antitoxine « classique » à deux composants, l’antitoxine se fixe à la toxine et inhibe son activité (gauche). Dans le cas du système TAC, l’extension ChAD déstabilise l’antitoxine, l’empêchant ainsi d’inhiber la toxine (centre). Le chaperon SecBTA dédié se fixe à la séquence ChAD et stabilise l’antitoxine, facilitant son interaction avec la toxine (droite).
© LMGM/CBI. P. Genevaux
En savoir plus
-
Chaperone addiction of toxin-antitoxin systems.
Nat Commun. 2016 Nov 9;7:13339. doi: 10.1038/ncomms13339.
Bordes P, Sala AJ, Ayala S, Texier P, Slama N, Cirinesi AM, Guillet V, Mourey L, Genevaux P.