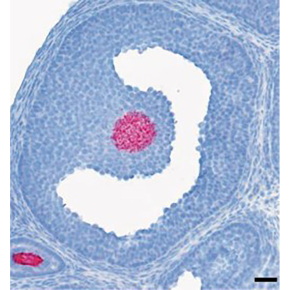
R-spondin2, un facteur essentiel au fonctionnement de l’ovaire et à la fertilité
Les protéines R-spondins (RSPO) sont des activateurs de la voie de signalisation WNT/β-catenin, voie centrale dans le développement ovarien. Cette étude montre maintenant qu’après la formation de l’ovaire, RSPO2 devient essentiel au fonctionnement de l’ovaire en assurant la communication entre l’ovocyte et les cellules voisines de la granulosa pour permettre la croissance des follicules ovariens et, par voie de conséquence, la fertilité féminine. Ces travaux sont publiés dans la revue Cell Death and Differentiation.
Dans l'ovaire, la communication cellulaire entre l'ovocyte et les cellules somatiques voisines, ou cellules de la granulosa, est essentielle à la croissance folliculaire qui conduira à la libération de l'ovocyte lors de l'ovulation. Chez la souris, l’initiation de la croissance folliculaire se traduit, au moment de la naissance, par la rupture d’une structure histologique, les cordons ovigères et l’individualisation des cellules germinales qui s’entourent d’une couche de cellules de la granulosa allongées, pour former un follicule primordial. Une fois formés, la plupart des follicules primordiaux entrent dans une phase de repos jusqu'à leur activation pendant le processus cyclique de l'ovulation.
Les follicules primordiaux activés subissent ensuite une croissance rapide avec une augmentation du volume ovocytaire et la prolifération des cellules de la granulosa qui changent de forme pour favoriser les contacts intercellulaires entre cellules de la granulosa adjacentes et leur adhésion à la surface des ovocytes. La croissance folliculaire se poursuit avec la formation d'une deuxième couche interne de cellules de la granulosa conduisant à la formation de follicules secondaires. D'autres divisions des cellules de la granulosa donnent ensuite naissance à des follicules tertiaires, antraux et pré-ovulatoires avec une granulosa composée de plus de
50 000 cellules.
L’expression du gène Rspo2, décrite dans l’ovocyte vers la naissance, suggérait un rôle important dans la croissance folliculaire et a attiré l’attention de nombreuses équipes travaillant sur les problèmes d’insuffisance ovarienne. Cependant les études menées in vitro, ont donné des résultats contradictoires et la fonction ovarienne in vivo du gène Rspo2 restait incertaine. Dans la présente étude, les chercheurs ont montré qu’in vivo l'expression de RSPO2/Rspo2 (gène humain/murin) est restreinte à l'ovocyte des follicules en croissance chez l’humain comme chez la souris. Ils montrent que chez cette dernière, l‘inactivation du gène codant pour la protéine RSPO2 n'altère pas la croissance des ovocytes, mais empêche la prolifération des cellules de la granulosa voisines, entraînant ainsi un arrêt de la croissance folliculaire.
Les scientifiques ont également montré que cet arrêt du cycle cellulaire est indépendant de la voie de signalisation de GDF9, un facteur reconnu pour favoriser cette croissance, mais est plutôt associé à une régulation négative de la voie de signalisation WNT/ β-catenin dans les cellules de la granulosa. Pour confirmer le rôle de cette voie de signalisation dans la croissance folliculaire, ils ont utilisé un modèle de délétion conditionnelle de Ctnnb1 (β-catenin) dans les cellules de la granulosa. Les follicules dépourvus de CTNNB1 ne se développent pas au-delà du stade primaire. Les résultats montrent que RSPO2 agit de manière paracrine pour activer la prolifération des cellules de la granulosa dans les follicules en développement précoce.
Cette étude démontre que l'activation de la signalisation WNT/β-catenin par la protéine RSPO2 est essentielle à l’interaction entre l’ovocyte et les cellules de la granulosa et conditionne la maturation des follicules ovariens, et par conséquent la fertilité féminine.
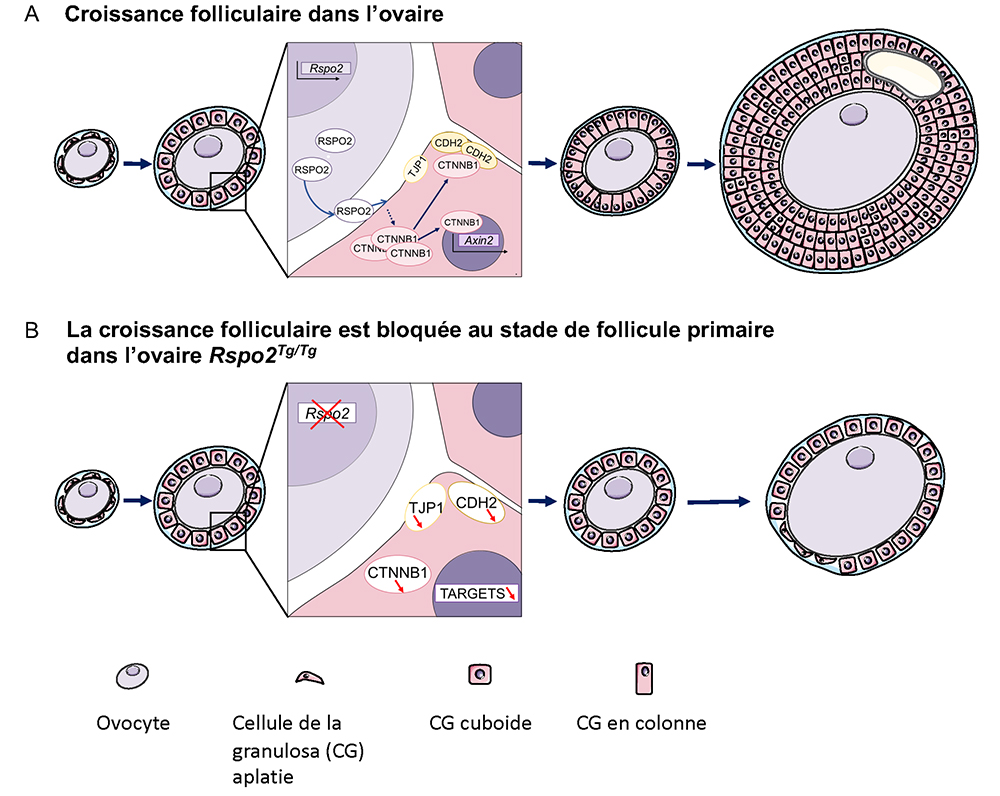
Figure : Modèle de signalisation de RSPO2 dans l’ovaire de souris.
RSPO2 favorise la stabilisation de CTNNB1 dans les cellules de la granulosa, essentielle à leur prolifération et à leur adhésion, et donc à la croissance folliculaire.
En l’absence de RSPO2, CTNNB1 diminue dans les cellules de la granulosa, leur prolifération est altérée et les follicules restent bloqués au stade de follicules primaires.
Pour en savoir plus
R-spondin2 signaling is required for oocyte-driven intercellular communication and follicular growth.
De Cian MC, Gregoire EP, Le Rolle M, Lachambre S, Mondin M, Bell S, Guigon CJ, Chassot AA, Chaboissier MC.
Cell Death Differ. 2020 Apr 27. doi: 10.1038/s41418-020-0547-7. [Epub ahead of print]
Contact
Laboratoire
Institut de Biologie Valrose (iBV) - (CNRS/Inserm/Université Côte d’Azur),
Parc Valrose, 06108 NICE cedex 2, France