Le microbiote intestinal est le « couteau suisse » de la nutrition chez la drosophile
Une croissance juvénile optimale repose sur une alimentation diversifiée et des études récentes démontrent le rôle important du microbiote intestinal dans ce processus. Une étude publiée dans la revue PLoS Biology, utilisant la drosophile, deux de ses partenaires bactériens majeurs et des milieux nutritionnels chimiquement définis, met en évidence comment des bactéries du microbiote intestinal maintiennent une croissance saine de leur partenaire animal malgré l’absence de nutriments normalement essentiels à sa croissance.
La croissance juvénile, définie comme la prise de poids et de taille lors de la période pré-pubère, est fortement impactée par l’alimentation. Des carences nutritionnelles durant cette période peuvent provoquer de graves retards de développement chez l’animal et chez l’Homme. Des études récentes ont montré que les bactéries du microbiote intestinal jouent un rôle important dans ce lien entre nutrition et développement, mais ce rôle est encore mal compris.
Les scientifiques ont utilisé un modèle simple d’interactions entre un hôte animal, la drosophile, son microbiote et sa nutrition. Ce modèle permet le contrôle du microbiote par l’utilisation de larves de drosophiles gnotobiotiques (c.a.d. avec un microbiote connu et contrôlé) : des larves axéniques, (c.a.d. dépourvues de microbiote) que les chercheurs ont associées avec deux espèces bactériennes commensales de la mouche : Acetobacter pomorum (Ap) et Lactobacillus plantarum (Lp). Ce modèle expérimental permet également un contrôle fin de la nutrition en élevant ces larves gnotobiotiques sur des milieux nutritifs chimiquement définis contenant 39 nutriments purifiés (vitamines, lipides, acides aminés, sels minéraux…).
Grace à ce model expérimental, les scientifiques ont testé de manière systématique l’importance de chacun de ces 39 nutriments pour la croissance juvénile de la drosophile, en les retirant un par un du milieu et en observant la capacité des larves à se développer sur ce milieu carencé. Les larves axéniques se sont révélées incapables de se développer en l’absence de 22 de ces 39 nutriments. Ces 22 nutriments sont donc essentiels à la croissance des larves. Cependant, ils ont observé que les larves associées aux bactéries commensales sont capables de se développer même en l’absence de ces nutriments essentiels : Lp permet de compenser 12 des 22 besoins nutritionnels et Ap permet d’en compenser 19.
Les scientifiques ont ensuite étudié comment Ap et Lp compensaient les besoins nutritionnels de leur hôte. Ils ont cherché si Ap et Lp étaient capables de produire les nutriments en question par trois approches parallèles. Tout d’abord, une approche bioinformatique a permis de déterminer si Ap et Lp possédaient, codées dans leur génome, les capacités à synthétiser ces composés. Une deuxième approche a consisté à tester l’auxotrophie de Ap et Lp à ces composés : les bactéries sont-elles capables de pousser en leur absence ? Enfin, une approche biochimique a permis de quantifier la présence de ces composés dans des cultures de Ap et Lp.
Ces trois approches ont permis de mettre en évidence que dans certains cas (principalement pour les acides aminés), Ap et Lp peuvent fournir directement les nutriments manquants à leur hôte. Dans d’autres cas (principalement des vitamines), Ap et Lp fournissent des molécules chimiquement proches, que la larve peut ensuite utiliser en remplacement du nutriment manquant. Enfin, Ap et Lp peuvent compenser l’absence de zinc, un métal qui ne peut être produit par les bactéries. Les chercheurs font l’hypothèse que les bactéries absorbent des traces contaminantes de zinc présentes dans l’environnement, les concentrent et les délivrent à leur hôte.
Ainsi, par ces différents mécanismes, Ap et Lp permettent à leur hôte animal de maintenir une croissance saine malgré l’absence de nutriments normalement essentiels à sa croissance. Ce travail établit les bases d’études futures visant à disséquer précisément les interactions entre la drosophile, ses bactéries commensales et sa nutrition et son métabolisme et souligne l’importance du microbiote intestinal comme « couteau suisse » de la nutrition des animaux.
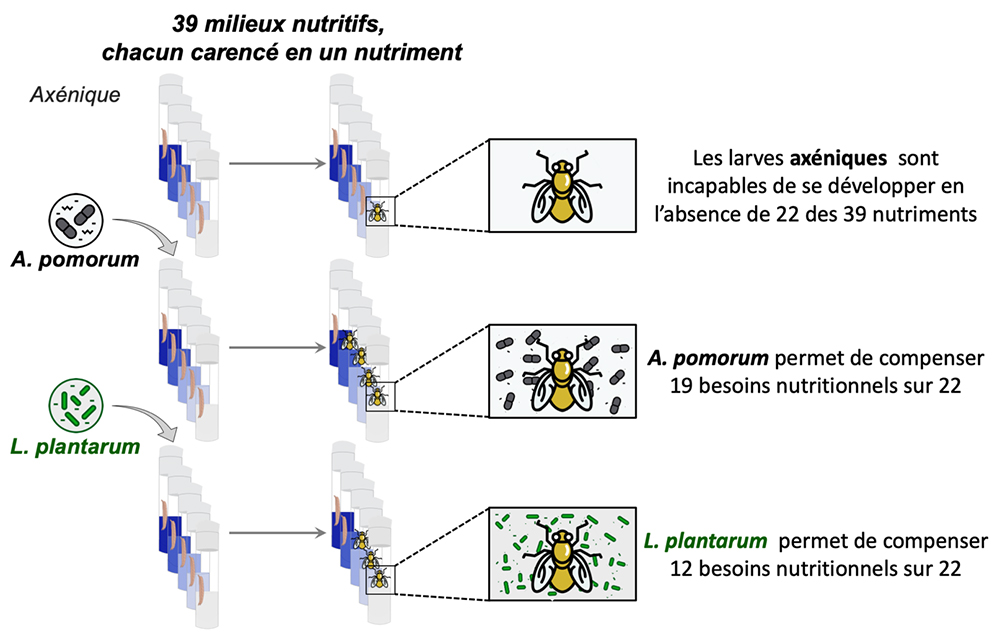
Figure : les scientifiques ont testé les capacités de développement de larves de drosophile sur 39 milieux nutritionnels, chacun manquant un nutriment, dans trois conditions : axénique (en haut), association avec la bactérie commensale Acetobacter pomorum (au milieu), association avec la bactérie commensale Lactobacillus plantarum (en bas). Quand les larves sont auxotrophes au nutriment manquant, elles ne parviennent pas à se développer et restent au stade larvaire. Quand elles ne sont pas auxotrophes, ou que les bactéries compensent la carence, elle se développent jusqu’au stade adulte.
Pour en savoir plus :
Drosophila-associated bacteria differentially shape the nutritional requirements of their host during juvenile growth.
Consuegra J, Grenier T, Baa-Puyoulet P, Rahioui I, Akherraz H, Gervais H, Parisot N, da Silva P, Charles H, Calevro F, Leulier F.
PLoS Biol. 2020 Mar 20;18(3):e3000681. doi: 10.1371/journal.pbio.3000681. [Epub ahead of print]
Contact
Laboratoire
Institut de Génomique Fonctionnelle de Lyon (IGFL) - (CNRS/Ecole Normale Supérieure de Lyon/ Université Claude Bernard Lyon-1)
46 Allée d'Italie 69364 Lyon Cedex 07