Hedgehog, une molécule impliquée dans le contrôle de la durée de vie
Pendant le vieillissement, les mécanismes impliqués dans le maintien de l'intégrité du cerveau sont encore mal compris. Dans cette étude publiée dans la revue Cell Reports les chercheurs montrent que, dans le modèle de la drosophile, la molécule Hedgehog, connue pour son rôle « organisateur de tissus » au cours du développement embryonnaire est réutilisée au cours de la vie adulte pour protéger les cellules gliales et l’intégrité neuronale, permettant ainsi d’augmenter la durée de vie de l’animal.
L'accroissement considérable de l'espérance de vie a abouti à une recrudescence spectaculaire des maladies et de la mortalité liées à l’âge, notamment une augmentation des maladies neurodégénératives comme la maladie d’Alzheimer. Au niveau cellulaire, le vieillissement est associé à une perte de cellules irremplaçables, telles que les neurones et les cellules gliales de soutien dans le cerveau, entraînant une altération des réseaux neuronaux et des fonctions cognitives. Il existe de nombreux mécanismes impliqués dans le vieillissement cellulaire, cependant, nos connaissances concernant les principales molécules circulantes impliquées dans le maintien de l'intégrité du cerveau adulte restent limitées.
L’objectif de cette étude était de savoir si la molécule circulante Hedgehog (Hh) connue depuis longtemps pour ses fonctions d’organisation au cours du développement des tissus embryonnaires, pouvait avoir également un rôle pendant la vie adulte. En utilisant la drosophile comme système modèle les chercheurs ont modifié génétiquement l’animal de manière à supprimer l’activité Hh à partir seulement des premiers jours de la vie adulte pour s’affranchir de tout problème développemental. Dans ce cadre, l’absence de Hh induit une forte diminution de la longévité de l’animal, associée à une perte de l’intégrité des neurones dopaminergiques et de l’activité locomotrice. Plus impressionnant, les auteurs ont également montré qu’une simple élévation, uniquement pendant la vie adulte, du niveau de la protéine Hh entraine l’augmentation de la mobilité et de la durée de vie de l’animal. En effet, l’activité Hh dans le cerveau adulte stimule les cellules gliales, et leur simple activation chez le mutant permet la restauration des neurones dopaminergiques, de la mobilité et de la longévité du mutant.
Au niveau moléculaire, les chercheurs montrent qu’en réponse à Hh, les cellules gliales qui sont fortement impliquées dans l’intégrité neuronale, expriment des molécules appelées chaperonnes. Ces protéines sont connues pour agir en coopération pour empêcher à la fois le mauvais repliement des protéines nouvellement synthétisées et l'agrégation des protéines lors d'un stress cellulaire. De manière remarquable, l’expression de deux de ces protéines chaperonnes (Hsp40 et Hsp68) dans la glie des mouches mutantes Hh, exerce un puissant effet neuro-protecteur, avec sauvetage des défauts neuronaux, de la locomotion et de la longévité de l’animal.
Pour confirmer ces résultats, l’équipe a utilisé un modèle moléculaire de la maladie d’Alzheimer chez la drosophile, modèle dans lequel des agrégats protéiques sont observés dans les cellules du cerveau. Ces agrégats sont responsables d’une mobilité et d’une longévité restreintes chez la mouche. Dans ce modèle, les auteurs montrent que l’activation des cellules gliales par Hh réduit les agrégats protéiques et corrige partiellement la locomotion et la longévité suggérant ainsi que la communication gliale-neuronale dans le cerveau adulte est contrôlée par Hh ce qui protège les neurones.
Cette nouvelle fonction de Hh comme acteur de la régulation de la durée de vie est probablement conservée chez les mammifères. En effet, l'homologue chez les vertébrés, Sonic Hedgehog (Shh), est présent dans le cerveau de souris et les cellules gliales murines répondent à ce signal. On sait également que Shh a un rôle protecteur contre diverses neurotoxines in vitro. Cette nouvelle étude suggère que la perte d’activation de la glie par Shh pourrait être impliquée dans les maladies neurodégénératives causées par l'agrégation de protéines aberrantes qui s’accumulent avec l’âge, ouvrant ainsi de possibles pistes thérapeutiques.
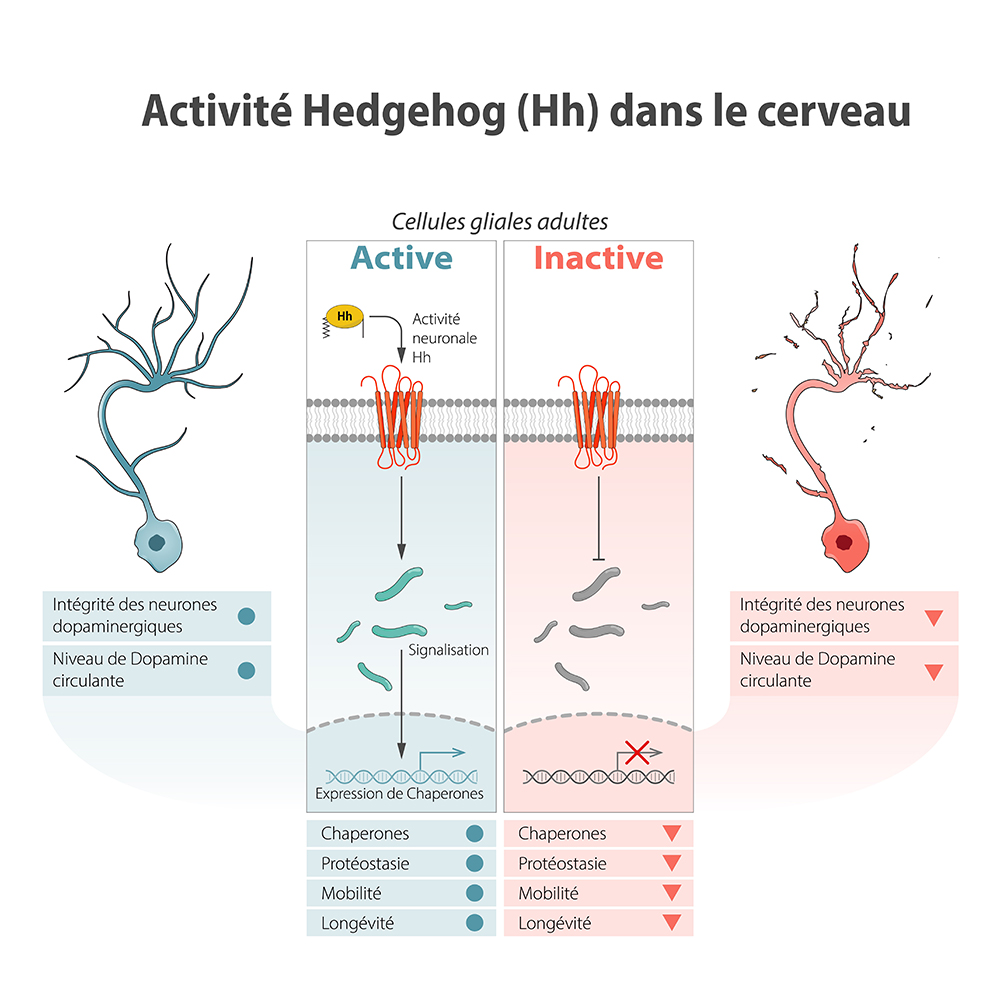
Figure : L’activité Hedgehog (Hh) dans le cerveau de drosophile active les cellules gliales, en régulant l’expression de molécules chaperonnes contrôlant le maintien de l’homéostasie protéique (protéostasie) de ces cellules. Indirectement, ceci entraine un effet neuro-protecteur sur différents neurones, incluant les neurones dopaminergiques. En absence de Hh, l’effet neuro-protecteur des cellules gliales est affecté, entraînant une perte de l’intégrité neuronale, perte de mobilité et de longévité.
Pour en savoir plus:
Hedgehog Signalling Modulates Glial Proteostasis and Lifespan
Rallis A, Navarro JA, Rass M, Hu A, Birman S, Schneuwly S, Thérond PP
Cell Reports; 25 février 2020. DOI: https://doi.org/10.1016/j.celrep.2020.02.006
Contact
Laboratoire
Institut de Biologie Valrose (iBV) - (CNRS / Inserm / Université Côte d'Azur)
Sophia Antipolis
06108 Cedex 2