Les agrégats de la protéine impliquée dans la maladie de Parkinson à l’échelle atomique
L’agrégation de la protéine alpha-synucléine est intimement liée à la maladie de Parkinson. Nous ne savons que très imparfaitement comment ces agrégats délétères se forment et quelles sont leurs propriétés de surface. La structure à l’échelle atomique de ces agrégats vient d’être obtenue en combinant des techniques de biochimie et de biologie structurale. Les résultats sont publiés dans la revue eLife.
L’alpha-synucléine est une petite protéine qui, lorsqu’elle s’agrège, est responsable de maladies neurodégénératives appelées synucléinopathies dont la maladie de Parkinson est la principale représentante. L’élucidation de la structure, à l’échelle atomique, de l’empilement des molécules d’alpha-synucléine qui composent les agrégats présents dans le cerveau des malades est une étape clé pour concevoir de nouvelles molécules (ligands) ciblant ces agrégats. La fixation de ces ligands le long ou aux extrémités de ces empilements permettrait alors de modifier leurs propriétés de surface ou leurs capacités d’élongations et ainsi interférer avec les processus pathologiques.
Dans le cadre d'une collaboration internationale, les chercheurs viennent de déterminer la structure à l’échelle atomique l’un des assemblages fibrillaires d’alpha-synucléine, qui entraînent, lors de leur injection à des rongeurs, l’apparition des caractéristiques de la maladie de Parkinson. Ce résultat a été obtenu en combinant des techniques de biochimie à des techniques de biologie structurale (dont les inventeurs ont été distingués par des Prix Nobel en 1991, 2002 et 2017) i.e la résonance magnétique nucléaire du solide et la cryo-microscopie électronique appliquées aux protéines.
Ce travail apportera une meilleure compréhension de la formation des agrégats et permettra le développement de ligands ciblant les fibres d’alpha-synucléine. Ces nouvelles molécules auront pour but de discriminer les agrégats pathogènes de la forme normale de la protéine, ou d’empêcher la croissance des agrégats en se fixant à leurs extrémités. Cette étude collaborative pluridisciplinaire ayant permis la description à l’échelle nanoscopique de l’assemblage des agrégats d’alpha-synucléine pourrait ouvrir de nouvelles perspectives dans le domaine de la maladie de Parkinson.
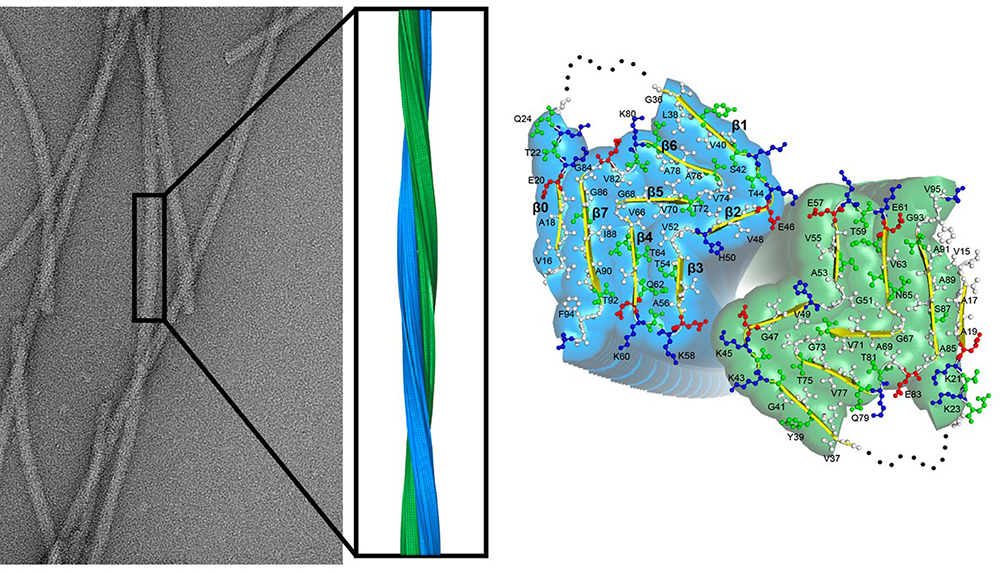
Figure : Empilement fibrillaire de la protéine alpha-synucléine observé au microscope électronique. La reconstruction tridimensionnelle de l’empilement à une résolution atomique vu de côté révèle que les fibres sont constituées de deux protofilaments (bleu et vert) qui s’enroulent l’un autour de l’autre. L’extrémité des fibres d’alpha-synucléine est montrée à droite. Elle révèle le repliement de deux molécules d’alpha-synucléine se faisant face dans les fibres et l’orientation des chaines latérales des acides aminés. La structure montre que l’alpha synucléine adopte la même conformation dans les deux protofilaments constituants la fibre d’alpha-synucléine. Elle montre aussi que les deux protofilaments sont liés par deux paires d’interactions électrostatiques entre une lysine (K45) un acide glutamique (E57) se faisant face
Pour en savoir plus :
Two new polymorphic structures of human full-length alpha-synuclein fibrils solved by cryo-electron microscopy
Guerrero-Ferreira R, Taylor NMI, Arteni AA, Kumari P, Mona D, Ringler P, Britschgi M, Lauer ME,
Makky A, Verasdock J, Riek R, Melki R, Meier BH, Böckmann A, Bousset L, Stahlberg H
eLife 9 Dec 2019 doi: 10.7554/eLife.48907
