Une stratégie de résistance à un inhibiteur métabolique découverte grâce à la levure
Les cellules cancéreuses prolifèrent de manière incontrôlée. Ceci s’accompagne d’une capacité accrue à importer les nutriments et à les métaboliser. Le dérivé toxique d’un sucre, le 2-désoxyglucose (2DG), est préférentiellement importé par les cellules cancéreuses et inhibe leur croissance. En utilisant la levure de boulanger comme organisme modèle, les chercheurs ont précisé les effets cellulaires de cette drogue et les mécanismes de résistance associés. Ces résultats sont publiés dans la revue Science Signaling
Les cellules prélèvent dans leur environnement extracellulaire les nutriments qui sont ensuite utilisés comme éléments constitutifs et qui peuvent aussi fournir l'énergie nécessaire à la prolifération des cellules et à l'augmentation de leur biomasse. Dans des pathologies comme le cancer, où les cellules prolifèrent de manière incontrôlée, elles augmentent leur capacité à importer des nutriments tels que le glucose et assurent son métabolisme par un processus appelé "glycolyse". Cela a conduit à l'idée que des médicaments affectant la glycolyse pourraient être utilisés en combinaison avec d'autres traitements dans les chimiothérapies.
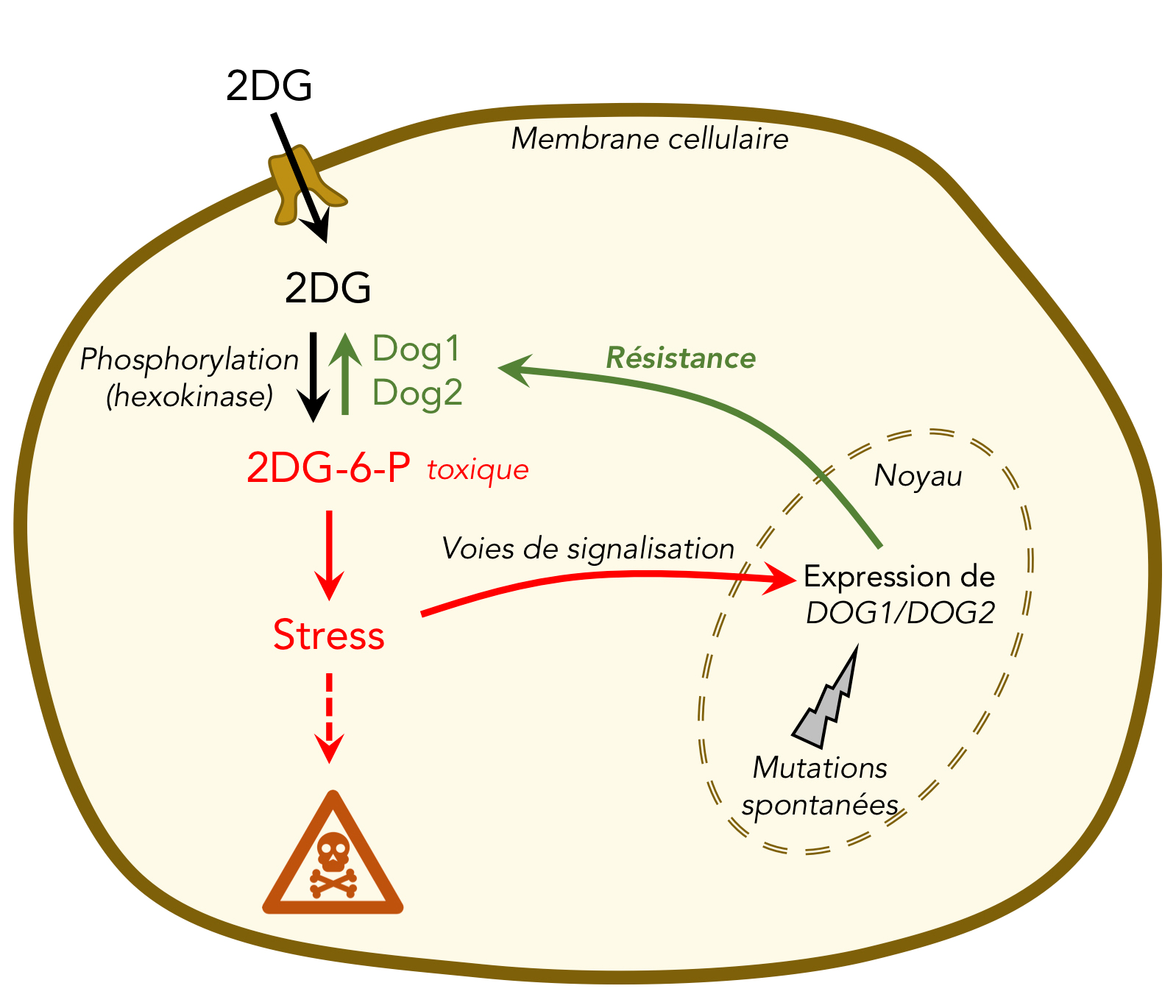
Le dérivé toxique du glucose, appelé 2-désoxyglucose (2DG), est un inhibiteur bien connu de glycolyse. Le 2DG est importé dans les cellules comme le glucose, mais lorsqu'il est métabolisé au cours de la glycolyse, il génère des espèces toxiques qui entraînent la mort cellulaire. Les conséquences du traitement au 2-désoxyglucose ne sont pas bien comprises pas plus qu'une résistance à cet inhibiteur observée dans le passé.
Les chercheurs ont utilisé un organisme unicellulaire simple, la levure de boulanger Saccharomyces cerevisiae, comme modèle expérimental pour comprendre les conséquences cellulaires du traitement au 2DG et la manière dont les cellules peuvent devenir résistantes à cet inhibiteur. Ils ont constaté que l'exposition au 2DG entraîne une augmentation de la quantité de deux enzymes (Dog1 et Dog2) chargées de déphosphoryler un métabolite dérivé du 2DG (2DG-6-P) afin qu'il ne soit plus toxique. Ils ont défini les événements de signalisation cellulaire à l'origine de cette induction et ont constaté que le 2DG provoque plusieurs stress qui agissent en synergie pour maximiser l'expression de ces enzymes, conduisant à une tolérance à de faibles concentrations de 2DG.
Les scientifiques ont également caractérisé des mutants spontanés de levure devenus résistants à des concentrations plus élevées de 2DG. L'analyse génomique de ces mutants a révélé que les enzymes étudiées participent aux stratégies de résistance de la plupart de ces mutants, notamment par la surexpression de Dog2.
Une enzyme similaire (HDHD1) présentant une similitude de séquence de 39% avec Dog2, a été identifiée chez l’homme. A l'instar de ses homologues de levure, elle protège les lignées cellulaires humaines de la mort cellulaire induite par le 2DG lorsqu'elle est abondamment exprimée.
© Sébastien Léon
Pour en savoir plus :
The regulation of HAD-like phosphatases by signaling pathways modulates cellular resistance to the metabolic inhibitor 2-deoxyglucose.
Defenouillère Q, Verraes A, Laussel C, Friedrich A, Schacherer J, Léon S
Science Signaling 03 Sep 2019. https://doi.org/10.1126/scisignal.aaw8000