Rencontre avec Valérie Borde, chercheuse au centre de recherche Institut Curie
Valérie Borde est chercheuse CNRS à l’institut Curie de Paris. Ses recherches se focalisent sur le mécanisme de la recombinaison s’effectuant entre les chromosomes parentaux au cours de la méiose. Invitée aux rencontres Etonnant Vivant, elle est venue présenter ses derniers résultats en compagnie de Aurore Sanchez, postdoctorante, et Alexandra Pyatniskaya, étudiante en thèse.

© CNRS Aurélie Meilhon
« Mon parcours scientifique »
Après une thèse réalisée sur l’action des topoisomérases, des enzymes qui coupent transitoirement l’ADN pour le relâcher ou le surenrouler, je suis partie en stage postdoctoral aux Etats-Unis, pour étudier la recombinaison méiotique, où il venait d’être découvert qu’une nouvelle topoisomérase, Spo11, jouait un rôle clé, en brassant les génomes parentaux pour créer des gamètes au contenu chromosomique unique. J’ai continué à développer ce sujet à mon retour en France, d’abord en rejoignant une équipe de recherche, puis quelques années plus tard, au sein de ma propre équipe, ce qui m’a permis de lancer des projets nouveaux et d’encadrer et former d’autres chercheurs et étudiants.
« Mes recherches »
Dans mon équipe, nous étudions le mécanisme de la recombinaison qui a lieu entre les chromosomes homologues parentaux au cours de la méiose. Ce processus a deux fonctions : l’une, mécanique, permet d’assurer une ségrégation égale des chromosomes parentaux dans chaque gamète (ovocyte et spermatozoïde) qui sera utilisé pour la reproduction sexuée. Cette fonction est remplie par les crossingover, points d’échange de bras entre les chromosomes. L’autre fonction est d’augmenter la diversité génétique et d’accélérer l’évolution des génomes.
Notre modèle d’étude est la levure Saccharomyces cerevisiae qui utilise pour la méiose des mécanismes très conservés avec ceux des mammifères, et permet tout un éventail d’approches moléculaires, génomiques et protéomiques. En complément de nos études in vivo, nous collaborons avec des biochimistes et des biologistes structuraux pour décortiquer les mécanismes mis en jeu. En particulier, nous avons découvert les facteurs qui dictent le choix des sites de recombinaison le long des chromosomes, et identifié des nouveaux complexes protéiques spécifiquement impliqués dans la formation des crossingover.
« Ce que j’aime dans mon métier »
L’excitation de la découverte, le plaisir d’élaborer avec mes collaborateurs des expériences pour répondre à une question, et de former de jeunes chercheurs et étudiants. Aussi les interactions et le partage des données avec les collègues lors de congrès scientifiques. Enfin, les collaborations avec des équipes venant d’autres disciplines, qui nous permettent de mieux approfondir et d’avoir un autre regard.
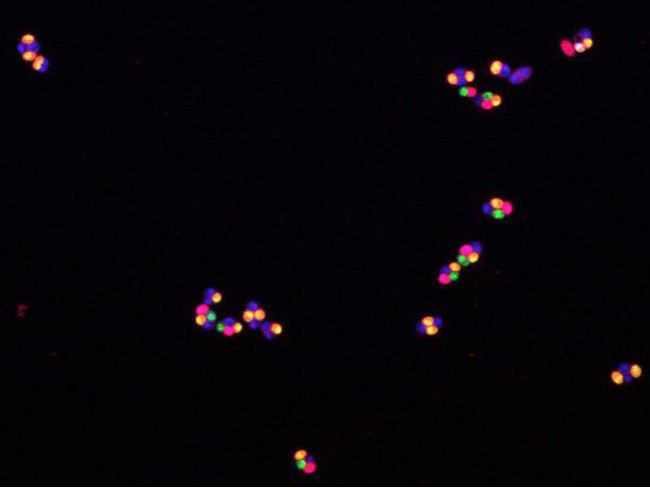
© Elsa Brachet et Valérie Borde, Institut Curie
En savoir plus :
- De Muyt, A., Pyatnitskaya, A., Andréani, J., Ranjha, L., Ramus, C., Laureau, R., Fernandez-Vega, A., Holoch, D., Govin, J., Margueron, R., Couté, Y., Cejka, P., Guérois, R. and Borde, V. (2018) A meiotic XPF-ERCC1-like complex recognizes joint molecule recombination intermediates to promote crossover formation. Genes and Development 32, 1-14.
- Adam, C., Guérois, R., Citarella, A., Verardi, L., Adolphe, F., Béneut, C., Sommermeyer, S., Ramus, C., Govin, J., Couté, Y. and Borde, V. (2018) The PHD finger protein Spp1 has distinct functions in the Set1 and the meiotic DSB formation complexes. PloS Genetics 14(2):e1007223.
- Duroc, Y., Kumar, R., Ranjha, L., Adam, C., Guérois, R., Md Muntaz, K., Marsolier-Kergoat, M.-C., Dingli, F., Laureau, R., Loew, D., Llorente, B., Charbonnier, J.-B., Cejka, P. and Borde, V. (2017) Concerted action of the MutLβ heterodimer and Mer3 helicase regulates the global extent of meiotic gene conversion. eLife 6, e21900.