Vieux amis et nouveaux venus dans la voie de signalisation de ERK chez les métazoaires non-chordés
La signalisation ERK est une voie de communication centrale au cours du développement qui est activée de façon canonique par des ligands extracellulaires qui se fixent sur des récepteurs Tyrosine kinase (RTK) et activent la protéine-G RAS. Une étude publiée dans la revue Nature Communications révèle cependant l’existence d’un mécanisme différent d’activation de la voie ERK, qui ne dépend, ni de ligand ni de RTK et qui est également indépendant de RAS, mécanisme qui pourrait opérer chez la plupart des organismes non-chordés. Ces découvertes révèlent l’existence d’une nouvelle branche « non canonique » à la voie de signalisation de ERK et suggèrent un possible mécanisme pour la co-option d’une voie de signalisation au cours de l’évolution.
La voie de signalisation communément appelée voie RTK/RAS/ERK est une voie de communication intercellulaire centrale qui relaie des informations de prolifération et de différenciation en provenance de récepteurs membranaires nommés récepteurs à activité Tyrosine Kinase (RTKs) vers la petite protéine G nommée RAS qui transmet à son tour l’information à un module de trois kinases cytoplasmiques qui s’activent en cascade par phosphorylation nommées RAF, MEK et ERK. Cette voie, qui est d’une importance cruciale au cours du développement, se retrouve également activé dans de très nombreux cancers et en particulier de cancers de la peau (mélanomes). La protéine RAF joue un rôle crucial dans l’activation du module RAF/MEK/ERK mais le mécanisme conduisant à son activation demeure mal compris. Des études réalisées chez la mouche du vinaigre D. melanogaster , le vers C. elegans et dans des cellules en culture ont montré que l’activation de RAF par RAS entraine sa dimérisation et nécessite l’intervention d’une troisième protéine nommée Kinase Suppressor of Ras (KSR), une protéine dont la séquence et la structure sont apparentées à RAF mais qui est dépourvue d’activité kinase. Le rôle de KSR dans le mécanisme d’activation de RAF serait d’agir comme un partenaire de dimérisation essentiel et un activateur allostérique de RAF.
Une exception à la règle de l’architecture linéaire de la voie ERK : la formation du squelette de l’embryon d’oursin.
Des travaux sur la formation du squelette de l’embryon d’oursin réalisés en 2004 avaient pointé une possible exception à la règle de l’activation linéaire de la voie RTK/RAS/MEK/ERK. En effet, les scientifiques avaient observé que l’activation de ERK dans les précurseurs du squelette de l’embryon ne dépendait ni de RAS, ni d’interaction cellulaire, ce qui allait à l’encontre du modèle établi et suggérait l’existence d’un mécanisme énigmatique d’activation de ERK dans ce modèle. Une nouvelle étude publiée dans la revue Nature Communications a permis de résoudre cette énigme. Les scientifiques ont découvert que l’activation de la voie ERK dans ces cellules est déclenchée non pas par un contrôle post-transcriptionnel impliquant la petite protéine G RAS mais par le contrôle de l’expression d’un gène codant un membre atypique de la famille de Kinase Suppressor of Ras (KSR), qu’ils ont nommé KSR3. Des travaux réalisés en parallèle dans les cellules en culture ont permis aux scientifiques de montrer que contrairement aux facteurs KSR1 et KSR2 de vertébrés qui sont incapables d’activer la voie lorsqu’ils sont surexprimés, KSR3 possède une puissante capacité à activer RAF et que la transfection de KSR3 dans des cellules en culture humaines est suffisante pour activer fortement la kinase ERK dans ces cellules. Enfin, une analyse structure fonction a permis de révéler que la structure de KSR3 ressemble à celle de formes oncogéniques de RAF, et que de nombreuses mutations activatrices se sont accumulées dans la séquence du gène ksr3. Afin de déterminer si ce mécanisme atypique d’activation de la voie ERK est une particularité rencontrée uniquement chez l’oursin, les scientifiques ont recherché la présence de ksr3 dans les génomes de plusieurs animaux situés à différentes positions dans l’arbre de l’évolution et ont réalisé une analyse par phylogénie. Cette étude leur a permis de découvrir que, de façon inattendue, des orthologues du gène ksr3 sont présents dans les génomes d’animaux appartenant à un grand nombre de phylums non-chordés y compris des phylums ayant divergé il y a environ 500 millions d’années tels que les placozoaires et les cnidaires. Il est à noter cependant que le gène ksr3 semble avoir été perdu chez les insectes et chez les nématodes ainsi que chez les chordés.
Cette étude réalisée chez l’oursin, fournit donc un exemple d’activation de la voie ERK qui se démarque nettement du modèle canonique. En effet, l’activation de ERK dans les précurseurs du squelette ne repose ni sur des ligands activant des RTKs, ni sur des mécanismes post-traductionnels impliquant la protéine RAS mais sur le contrôle spatial et temporel de l’expression d’un puissant activateur de RAF : le facteur KSR3. Ces travaux offrent de nouvelles perspectives de recherche concernant par exemple le rôle de cette voie d’activation de ERK non canonique, dépendante de KSR3, chez les animaux non-chordés. D’un point de vue évolutif, ces travaux permettent également d’entrevoir comment une voie de signalisation telle que la voie ERK pourrait être redéployée de façon économe dans un nouveau territoire ou un nouvel organe au cours de l’évolution (mécanisme de co-option). En effet, les scientifiques émettent l’hypothèse selon laquelle une modification du contrôle de l’expression temporelle et spatiale d’un seul gène tel que ksr3 pourrait permettre d’activer la voie dans un nouveau territoire. Un tel mécanisme serait donc plus parcimonieux que le recrutement de plusieurs gènes codant pour les ligands, les récepteurs RTKs et les co-récepteurs de la voie de signalisation canonique de ERK.
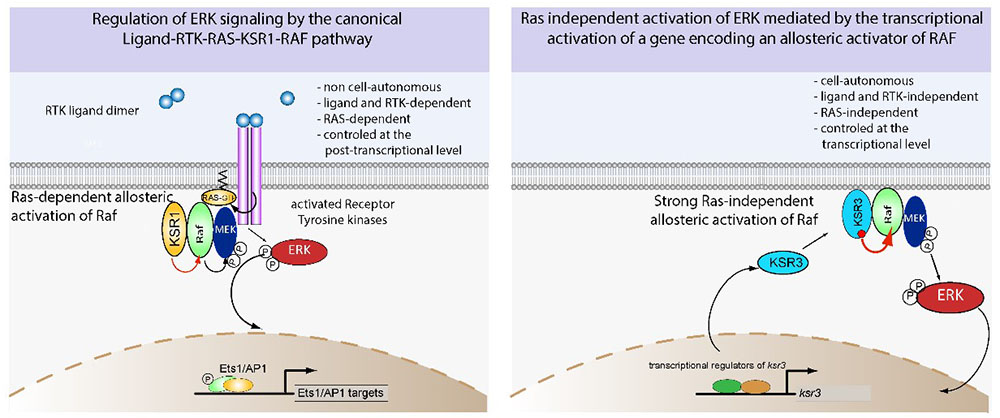
Figure : Un mécanisme d'activation de ERK indépendant de RAS présent chez les métazoaires non chordés. Panneau de gauche, voie canonique d’activation de ERK : l’activation de ERK repose sur la liaison de ligands à des récepteurs RTK et dépend de RAS, qui à son tour active RAF,MEK et ERK. Panneau de droite, le mécanisme d'activation de la signalisation ERK médiée par KSR3 ne nécessite pas de ligands ni de RTK et est indépendant de RAS.
En savoir plus :
RAS-independent ERK activation by constitutively active KSR3 in non-chordate metazoa | Nature Communications. Aline Chessel, Noémie De Crozé, Maria Dolores Molina, Laura Taberner, Philippe Dru, Luc Martin and Thierry Lepage. Nature Communications. DOI: https://doi.org/10.1038/s41467-023-39606-y
Contact
Laboratoire
Institut de biologie Valrose – iBV (CNRS/Inserm/Université Côte d'Azur)
Parc Valrose
06108 Nice
