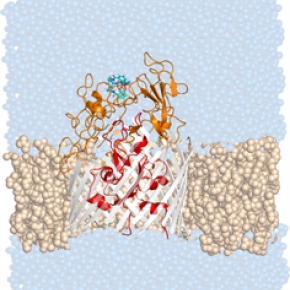
Une structure de protéine ouvre la voie à la conception d’antibiotiques utilisant la stratégie du Cheval de Troie
Une collaboration internationale a permis de décrire finement le mécanisme de transport du fer via un sidérophore (l’entérobactine) chez la bactérie Pseudomonas aeruginosa. Ces travaux, publiés dans la revue Nature Communications, permettent aujourd’hui d’envisager la conception rationnelle de vecteurs mimant ce sidérophore afin d’adresser sélectivement des antibiotiques à ce pathogène hautement résistant.
Le fer est un élément essentiel pour la majorité des êtres vivants. Afin d’acquérir ce nutriment crucial à partir de leur environnement, les bactéries sécrètent des sidérophores (du grec Sideros : fer et phorein : porter, transporter). Ces molécules complexent le fer avant d’être reconnues par des transporteurs spécifiques présents à la surface de la bactérie. Le processus de passage des complexes siderophore-fer au travers des transporteurs, restait une énigme malgré la publication de diverses structures de protéines de cette famille.
La combinaison entre la biologie structurale et moléculaire, la modélisation informatique et la chimie organique dans le cadre d’une collaboration européenne avec des équipes britanniques et italiennes a permis de décrire finement le mécanisme de transport d’un sidérophore, l’entérobactine, chez la bactérie Pseudomonas aeruginosa. Cette étude a mis en évidence l’existence, au niveau du transporteur, de deux sites de liaison successifs fonctionnant comme des points de contrôle (checkpoints) garantissant la sélectivité et l’efficacité de ce mode d’import.
Ces travaux permettent aujourd’hui d’envisager la conception rationnelle de vecteurs mimant l’entérobactine. En utilisant une stratégie de « Cheval de Troie », de tels vecteurs pourraient introduire efficacement des antibiotiques dans P. aeruginosa considéré par l’OMS comme l’un des organismes les plus critiques en termes de résistance à l’arsenal thérapeutique actuel.
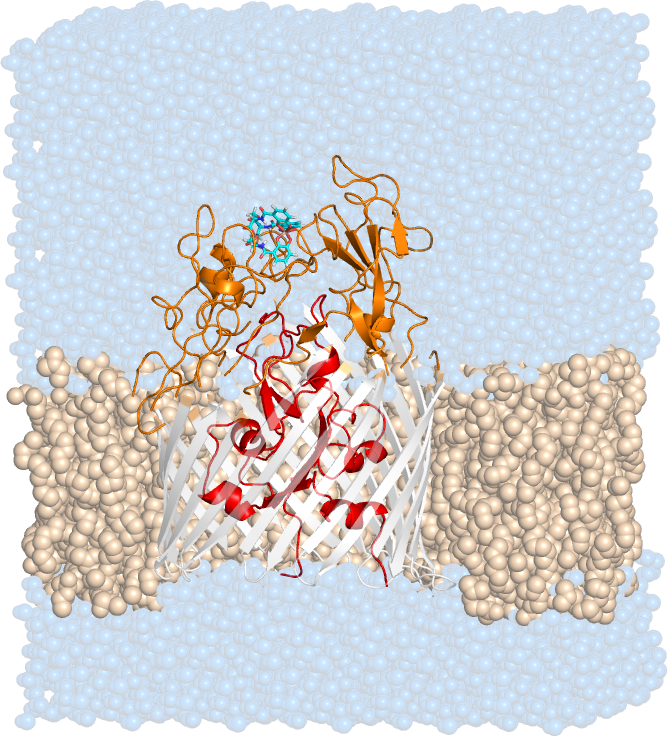
© Matteo Ceccarelli
Pour en savoir plus :
The complex of ferric-enterobactin with its transporter from Pseudomonas aeruginosa suggests a two-site model.
Moynié L, Milenkovic S, Mislin GLA, Gasser V, Malloci G, Baco E, McCaughan RP, Page MGP, Schalk IJ, Ceccarelli M, Naismith JH.
Nat Commun. 2019 Aug 14;10(1):3673. doi: 10.1038/s41467-019-11508-y.