Une protéine redox de l'œuf qui déverrouille le noyau du spermatozoïde
Le noyau du spermatozoïde est verrouillé dans un état chromatinien ultracompact incompatible avec la formation du zygote. L’équipe de Benjamin Loppin au laboratoire de Biométrie et de biologie évolutive, a élucidé le mécanisme qui permet son déverrouillage à la fécondation. Ces travaux réalisés grâce à l’étude d’un mutant de drosophile isolé il y a près de 25 ans, ont été publiés le 23 novembre 2016 dans la revue Nature Communications.
Parmi les nombreuses singularités du spermatozoïde, la plus remarquable est peut-être l’organisation de sa chromatine. Dans le gamète mâle, les protéines histones qui normalement organisent l'ADN du noyau de toutes les cellules sont en effet remplacées par des protéines spécifiques du gamète mâle appelées protamines. Les protamines confèrent à l'ADN du spermatozoïde un niveau de compaction extrême qui est incompatible avec la plupart des activités nucléaires. Chez certains groupes d'animaux, dont les mammifères placentaires, cette organisation ultracompacte est littéralement verrouillée par la formation d’un réseau tridimensionnel de liaisons covalentes, appelées ponts disulfures, qui relient entre elles les protamines associées à l’ADN. Les ponts disulfures sont formés entre les nombreux résidus cystéine présents dans les protamines. Cette organisation unique confère vraisemblablement une très grande résistance à la chromatine spermatique. Si il est bien établi que la décompaction du noyau mâle à la fécondation requiert la réduction préalable des ponts disulfures, le mécanisme impliqué reste encore peu clair.
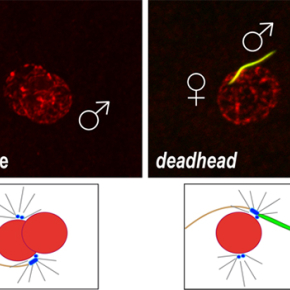
La drosophile est un modèle de choix pour étudier les mécanismes moléculaires qui permettent l’intégration des chromosomes paternels dans le zygote. Les mutants qui affectent cette étape aussi cruciale que fugace sont néanmoins extrêmement rares. C'est en revisitant un ancien mutant de stérilité femelle appelé deadhead, que les chercheurs de l’équipe "Epigénétique et Formation du Zygote" ont découvert l'implication d'une thiorédoxine spécifique de l'œuf dans la décompaction du noyau du spermatozoïde. Ces petites protéines universelles, connues pour leur rôle dans la régulation de l'équilibre redox de la cellule, ont justement pour fonction de réduire les ponts disulfures. De façon remarquable, les œufs dépourvus de la thiorédoxine Deadhead sont incapables de décondenser le noyau du spermatozoïde qui reste compacté en forme d'aiguille et contient toujours ses protamines (Figure 1).
Ainsi, la thiorédoxine Deadhead, qui n'est présente que transitoirement dans les œufs, "attend" le noyau du spermatozoïde pour réduire ses ponts disulfures à la fécondation. Une fois cette tâche accomplie, Deadhead est rapidement dégradée et disparait au bout de quelques minutes.
L'implication chez la drosophile de cette thiorédoxine très spécialisée remet en question l'hypothèse selon laquelle le déverrouillage du noyau mâle chez les mammifères serait un processus passif induit par le niveau réducteur intrinsèque de l'ovocyte. Enfin, cette étude démontre que le verrouillage de la chromatine spermatique par des ponts disulfures est une innovation apparue indépendamment chez la drosophile et les mammifères, ce qui constitue un remarquable exemple de convergence évolutive.
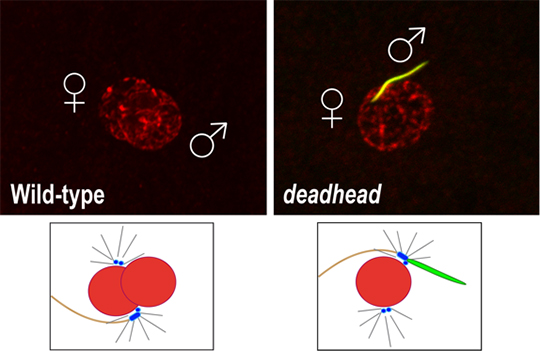
Figure :
Apposition des pronoyaux mâle et femelle à la fécondation chez la drosophile. A gauche, un œuf sauvage chez lequel les deux pronoyaux ont le même aspect. A droite, un œuf pondu par une femelle mutante deadhead. En l'absence de la thiorédoxine Deadhead, le noyau du spermatozoïde reste condensé en aiguille et ses protamines (en vert) ne sont pas éliminées. L'ADN est en rouge. Un pronoyau décondensé mesure environ 10 micromètres de diamètre.
© Benjamin Loppin
En savoir plus
-
Unlocking sperm chromatin at fertilization requires a dedicated egg thioredoxin in Drosophila
Nat Commun. 2016 Nov 23;7:13539. doi: 10.1038/ncomms13539
Tirmarche S, Kimura S, Dubruille R, Horard B, Loppin B.