Une protéine eucaryote au cœur de la synthèse du ribosome chloroplastique !
Le chloroplaste est un organite de la cellule végétale issu de l’endosymbiose ancienne d’une cyanobactérie et qui possède son propre génome. La traduction des gènes du chloroplaste est opérée par un ribosome dont la structure et la composition s’apparentent très fortement à celles de son homologue bactérien. Toutefois, des chercheurs ont démontré que chez la plante Arabidopsis thaliana, une protéine n’ayant aucune origine bactérienne s’associait au ribosome chloroplastique pour stimuler son assemblage et la traduction des gènes du chloroplaste. Ce travail est publié dans la revue Nucleic Acids Research.
Le chloroplaste est un organite cellulaire issu de l’endosymbiose d’une cyanobactérie qui permet à la cellule végétale de transformer le carbone atmosphérique en glucides lors de la photosynthèse. Le chloroplaste possède son propre génome. La traduction est opérée par un ribosome ribonucléoprotéique dont la structure et la composition s’apparentent très fortement à celles de son homologue bactérien. Ainsi, la production de ribosomes matures dans les chloroplastes suit un processus complexe qui fait intervenir de nombreux facteurs protéiques similaires à ceux de la bactérie. Toutefois, la coévolution entre les compartiments génétiques du noyau et de l’organite a permis l’émergence, dans les génomes de plantes, de familles de gènes codant de nouvelles protéines de liaison aux acides nucléiques impliquées dans le contrôle des différentes étapes de l’expression génétique du chloroplaste, dont la traduction. La protéine chloroplastique mTERF9 fait partie de ces protéines et appartient à la famille de facteurs de transcription, mTERF.
L’étude d’un mutant du gène mTERF9 chez Arabidopsis thaliana a démontré que mTERF9 stimule l’assemblage de ribosomes matures et la traduction des gènes dans les chloroplastes. Pour expliquer ce phénomène, les chercheurs ont effectué des expériences biochimiques de co-immunoprécipitation afin de révéler l’interactome protéique et ribonucléotidique de la protéine mTERF9 dans les chloroplastes. Les résultats de l’étude ont révélé que la protéine mTERF9 s’associe de manière préférentielle à de nombreuses protéines de la petite sous-unité du ribosome ainsi qu’à l’ARN ribosomique de cette sous-unité dans les chloroplastes et que ces interactions ribonucléoprotéiques stabilisent le ribosome mature in vivo. De plus, les chercheurs ont démontré que mTERF9 est incorporée dans les ribosomes en cours de traduction dans les chloroplastes. Des expériences d’ interaction protéine-protéine chez la levure et protéine-ARN in vitro ont permis de confirmer la capacité de la protéine mTERF9 a interagir directement avec certains de ses partenaires moléculaires in vivo. Les chercheurs suggèrent que la capacité de mTERF9 à interagir à la fois avec des protéines et l’ARN sous-tend sa fonction d’échafaudage pour l’assemblage du ribosome chloroplastique.
Cette étude illustre la complexité évolutive des mécanismes d’expression des gènes des organites d’origine endosymbiotique en révélant l’importance d’une protéine eucaryotique pour la synthèse du ribosome chloroplastique chez les plantes.
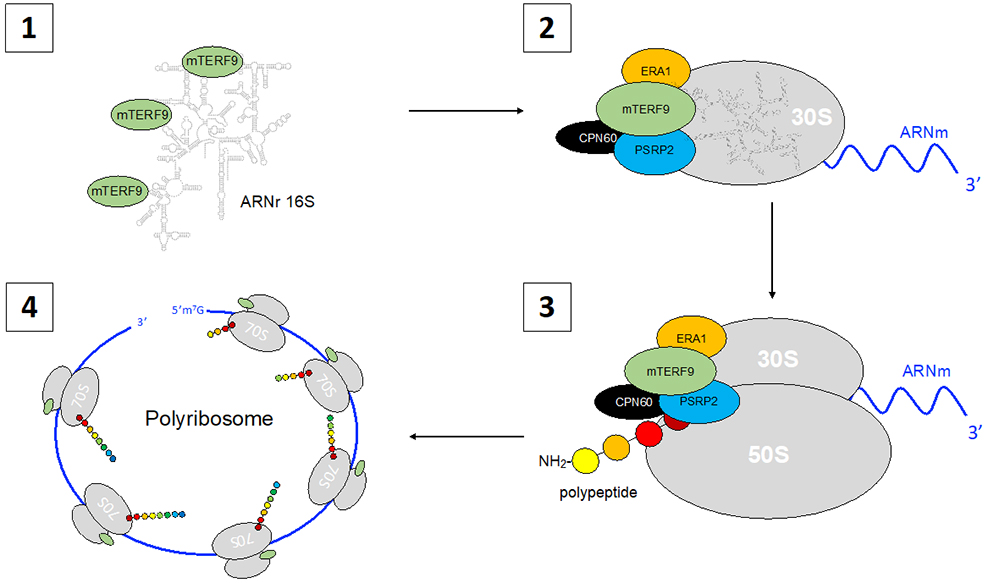
Figure : Rôle de la protéine mTERF9 dans la régulation de la traduction chloroplastique. 1) Dans les chloroplastes, la protéine mTERF9 lie l’ARN ribosomique ("16S"), un constituant de la petite sous-unité "30S" du ribosome. 2) mTERF9 interagit avec des protéines nécessaires à la biogenèse de la petite sous-unité 30S du ribosome, comme la protéine ribosomale PSRP2 et le facteur d’assemblage ERA1 mais également avec le complexe des chaperonines CPN60. 3) La protéine mTERF9 stimule l’assemblage des deux sous-unités ribosomiques 30S et 50S en un ribosome 70S mature. 4) La protéine mTERF9 reste associée aux polyribosomes où elle jouerait un rôle durant la synthèse protéique.
Pour en savoir plus :
Arabidopsis mTERF9 protein promotes chloroplast ribosomal assembly and translation by establishing ribonucleoprotein interactions in vivo.
Méteignier L.-V., Ghandour R., Zimmerman A., Kuhn L., Meurer J., Zoschke R., Hammani K.
Nucleic Acids Research.05 January 2021 https://doi.org/10.1093/nar/gkaa1244
Contact
Laboratoire
Institut de biologie moléculaire des plantes (IBMP) - (CNRS/Université de Strasbourg)
12, rue du général Zimmer 67084 Strasbourg
