Une nouvelle voie de modification de l’ergostérol chez les champignons
Les scientifiques ont mis à jour une nouvelle voie de modification de l’ergostérol par ajout d’acide aminé chez les champignons supérieurs. La modification est ARN-dépendante, et permet la synthèse d’ergostéryl-aspartate, un type de stérol conjugué inconnu jusqu’alors. L’enzyme responsable est similaire à des enzymes bactériennes de modification de glycérolipides.
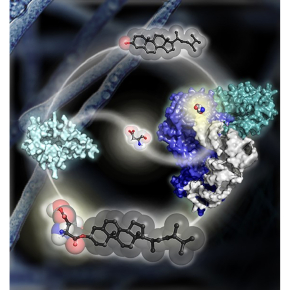
Les champignons représentent une famille d’organismes eucaryotes très variée. Pour répondre aux contraintes imposées par leur environnement, favoriser la compétition ou la coopération avec d’autres organismes ou réguler certains processus cellulaires, ils produisent une immense variété de composés – parfois d’intérêt médical ou biotechnologique – grâce à des systèmes enzymatiques uniques. En collaboration avec des équipes japonaise (Université Meiji, Tokyo) et américaine (Université de Floride) les chercheurs ont découvert que les champignons « supérieurs » possèdent une voie métabolique de synthèse d’un composé inconnu jusqu’alors et sans équivalent chez d’autres organismes, l’ergostéryl-3ß-O-L-aspartate (Erg-Asp). Il s’agit d’une forme modifiée de l’ergostérol (Erg), un constituant lipidique majeur et essentiel des membranes cellulaires chez les champignons, équivalent du cholestérol, auquel est ajouté un acide aminé, l’acide aspartique (Asp). L’étude montre que la synthèse de l’Erg-Asp est effectuée par un nouveau type d’enzyme, l’ergostéryl-3ß-O-L-aspartate synthase (ErdS), tandis que sa dégradation (le retrait de l’Asp) est catalysé par une Erg-Asp hydrolase, ErdH.
La découverte trouve son origine dans le fait qu’ErdS est apparentée à des enzymes de bactéries, les MprF, connues pour modifier les glycérolipides des membranes bactériennes par l’ajout d’acides aminés (aa) tels que la lysine (Lys). Etonnamment, les MprF n’utilisent pas les aa directement, mais seulement lorsqu’ils sont attachés à un ARN de transfert (ARNt) sous la forme d’aminoacyl-ARNt (aa-ARNt). Elles transfèrent ainsi l’aa porté par l’ARNt sur un ou plusieurs glycérolipides. Les aa-ARNt sont ces briques de construction universelles qu’utilise le ribosome, chez tous les êtres vivants, pour synthétiser les protéines. Ce processus nécessite 20 aa différents, et donc 20 aa-ARNt utilisables, produits par des enzymes spécialisées, les aminoacyl-ARNt synthétases. Par exemple, la lysyl-ARNt synthétase produit le Lys-ARNtLys à partir de Lys et de l’ARNtLys qui lui correspond avant qu’il ne soit détourné de la synthèse des protéines et utilisé par les MprF pour modifier les GLs. Chez les champignons, ErdS est bi-fonctionnelle : elle est à la fois une aspartyl-ARNt synthétase produisant de l’Asp-ARNtAsp à partir d’Asp et d’ARNtAsp mais aussi une Asp-ARNt transférase qui détache l’Asp de son ARNt, et le transfère sur l’Erg, pour produire l’Erg-Asp.
L’Erg-Asp est produit par de très nombreux champignons, notamment pathogènes, mais est passé inaperçu. Sa fonction demeure encore inconnue, mais sa conservation chez un grand nombre de champignons suggère qu’il pourrait être important dans leur physiologie. L’Erg est la cible principale des antifongiques utilisés actuellement en milieu hospitalier. De ce fait, le rôle de ce nouveau type de modification de l’Erg devra être exploré, afin d’établir s’il contribue à la résistance aux antifongiques des champignons, à leur pathogénie ou à leur virulence, comme les GLs le font chez les bactéries.
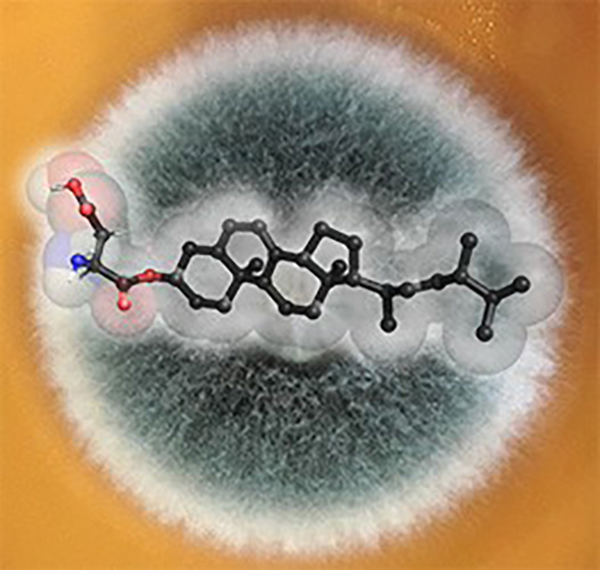
Figure : Les champignons « supérieurs », ici illustrés par une colonie filamenteuse d’Aspergillus fumigatus (une moisissure pathogène), synthétisent un nouveau type de composé, l’ergostéryl-3ß-O-L-aspartate (Erg-Asp, représenté en surimpression), résultat de la modification de l’ergostérol (Erg) avec l’acide aspartique (Asp) par une nouvelle enzyme, l’Erg-Asp synthase (ErdS).
Pour en savoir plus :
RNA-dependent sterol aspartylation in fungi
Yakobov N, Fischer F, Mahmoudi N, Saga Y, Grube CD, Roy H, Senger B, Grob G, Tatematsu S, Yokokawa D, Mouyna I, Latgé JP, Nakajima H, Kushiro T, D. Becker HD
Proc. Natl. Acad. Sci. USA; 30 juin 2020 https://doi.org/10.1073/pnas.2003266117
Contact
Laboratoire
Génétique Moléculaire Génomique Microbiologie (GMGM) - (CNRS/Université de Strasbourg)
Institut de Physiologie et de chimie Biologique - 4 allée Konrad Roentgen 67000 Strasbourg