Une nouvelle cible thérapeutique pour prévenir les dyskinésies dans la maladie de Parkinson
Dans un modèle murin de la maladie de Parkinson, apparaissent des plateformes de signalisation contenant à la fois les récepteurs de la dopamine et du glutamate, D1-mGlu5. La signalisation menant aux dyskinésies lors du traitement à la L-DOPA reposerait sur l’activation de ces plateformes. Ce travail publié dans Journal of Clinical Investigation définit une nouvelle cible thérapeutique pour prévenir les dyskinésies.
Pour pallier la dégénérescence massive des projections dopaminergiques, les patients parkinsoniens sont classiquement traités à la L-DOPA. Ce traitement restitue l’équilibre entre glutamate et dopamine, neurotransmetteurs responsables de la plasticité synaptique des neurones du striatum, et rétablit les fonctions cognitives associées. La L-DOPA permet notamment d’atténuer l'akinésie et la rigidité des patients parkinsoniens. Cependant, la L-DOPA induit aussi des dyskinésies indésirables (mouvements incontrolés). Ces effets atypiques de la dopamine seraient dus à des remaniements moléculaires au cours de la maladie de Parkinson qui modifieraient la signalisation dopaminergique.
Ce travail, dans un modèle murin de la maladie de Parkinson, montre l’apparition de structure ("plateformes de signalisation") contenant à la fois les récepteurs de la dopamine (D1) et du glutamate (mGlu5). Les résultats montrent que les récepteurs D1 et mGlu5 peuvent interagir physiquement et former des entités hétéromériques D1-mGlu5, jusqu'alors inconnues. Ces plateformes sont douées de propriétés de signalisation uniques au regard des récepteurs isolés. En particulier, l'hétéromère D1-mGlu5 entraine une activation excessive de la voie de signalisation médiée par la phospholipase (PLC) et la libération intracellulaire de calcium. Ces hétéromères D1-mGlu5 sont très abondants dans le striatum dénervé en dopamine dans le modèle de la maladie de Parkinson. En effet, le marquage des complexes endogènes par fluorescence sur tranches de cerveau révèle l’existence de ces plateformes de signalisation D1-mGlu5, bien que clairsemées, dans le striatum intact. Leur concentration augmente significativement après une dégénérescence dopaminergique nigrostriatale. Le nombre de punctas de D1-mGlu5 est encore supérieur après un traitement chronique à la L-DOPA. Les fonctions physiologiques de la dopamine et du glutamate semblent être régies par les récepteurs isolés, alors que la signalisation menant aux dyskinésies reposerait sur l’activation des plateformes intégrant les deux types de récepteurs, D1-mGlu5.
Empêcher la signalisation des dimères D1-mGlu5 formés pendant l'éthiologie de la maladie de Parkinson permettrait de prévenir les dyskinésies induites par la L-DOPA, tout en préservant les avantages anti-akinétiques de ce traitement. En effet, chez la souris, si la signalisation des complexes D1-mGlu5 est abolie pendant le traitement à la L-DOPA, l’effet antiparkinsonien bénéfique est préservé alors que les réponses moléculaires et motrices inadaptées menant aux dyskinésies indésirables disparaissent. On pourrait donc envisager de casser ces plateformes de signalisation aberrante pendant le traitement de substitution de la dopamine pour ne conserver que les effets désirables du traitement et s’affranchir des dyskinésies.
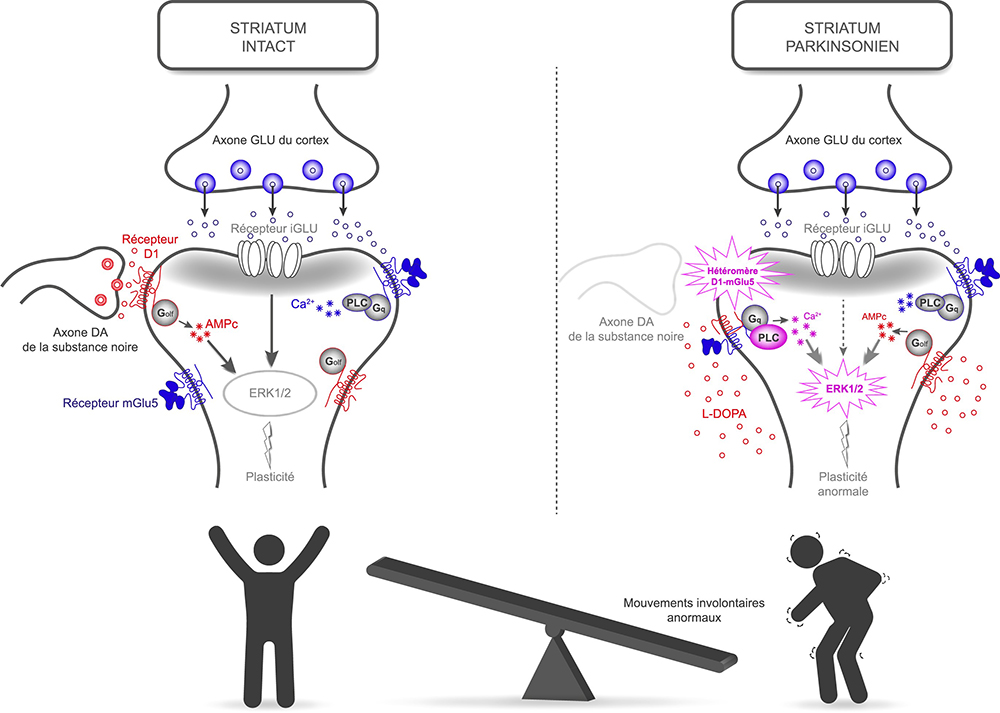
Figure : Schéma représentant les réponses moléculaires à la dopamine et au glutamate dans un striatum intact (à gauche) ou parkinsonien (à droite). La signalisation aberrante générée par les hétéromères D1-mGlu5 dans le cerveau parkinsonien entraine des réponses motrices inadaptées, dyskinésies indésirables lors du traitement de substitution de la dopamine.
Pour en savoir plus:
D1-mGlu5 heteromers mediate noncanonical dopamine signaling in Parkinson's disease.
Sebastianutto I, Goyet E, Andreoli L, Font-Ingles J, Moreno-Delgado D, Bouquier N, Jahannault-Talignani C, Moutin E, Di Menna L, Maslava N, Pin JP, Fagni L, Nicoletti F, Ango F, Cenci MA, Perroy J.
J Clin Invest. 2020 Mar 2;130(3):1168-1184. doi: 10.1172/JCI126361.
Contact
Laboratoire
Institut de Génomique Fonctionnelle (IGF) - (CNRS/Inserm/Univ. Montpellier)
141, rue de la cardonille
34094 Montpellier Cedex 05 - France
