Une nouvelle arme dans la guerre du fer
Le fer joue un rôle clé lors de l’interaction entre les microorganismes phytopathogènes et les plantes. Il est indispensable à la multiplication des microbes mais, en excès, il provoque la formation de molécules oxydantes très toxiques. Dans un article publié dans la revue Nature Communications, les chercheurs ont découvert une nouvelle famille de protéines produites par de nombreux microorganismes phytopathogènes pouvant lier le fer libéré par les tissus végétaux dégradés, protégeant ainsi les microorganismes du stress oxydatif.
Les microorganismes phytopathogènes dits « nécrotrophes » dégradent les tissus végétaux en sécrétant massivement des enzymes qui vont désorganiser les parois des cellules de la plante, ce qui provoque la lyse des tissus. Ceci va libérer des molécules utilisées par le microbe pour se nourrir mais aussi des composés qui peuvent être toxiques. Le fer et le cuivre sont nécessaires aux microorganismes, mais ils peuvent aussi catalyser, à partir de l’eau oxygénée produite par la plante pour se protéger, la formation de molécules oxydantes, les « espèces réactives de l’oxygène » (ROS), très toxiques pour le microorganisme.
La bactérie phytopathogène Dickeya dadantii est un agent de la pourriture molle de nombreux végétaux d’importance économique dont la pomme de terre et l’endive. Les chercheurs ont caractérisé une nouvelle protéine, IbpS, produite par cette bactérie. Cette protéine est sécrétée à l’extérieur de la bactérie où elle va séquestrer le fer et le cuivre, les empêchant de pénétrer dans la bactérie et de catalyser la formation de ROS. Elle contribue donc à une meilleure survie de la bactérie lors de l’infection de la plante et en conséquence à une virulence accrue.
La structure de protéine IbpS révèle qu’elle appartient à la large famille des Substrate Binding Proteins (SBP) mais présente quelques caractéristiques structurales uniques comme l’absence de site de fixation du substrat de haute affinité ou sa capacité à former des dimères, ce qui montre qu’elle est le prototype d’une nouvelle classe de SBP. L’analyse des séquences de protéines de cette famille au sein du monde vivant montre que des homologues de IbpS sont codés par le génome de nombreux phytopathogènes nécrotrophes eucaryotes comme le champignon Botrytis cinerea, agent de la pourriture grise, ou l’oomycète Phytophtora infestans, agent du mildiou de la pomme de terre. Ce transfert d’un gène codant une protéine Ibp depuis une bactérie vers les champignons semble avoir eu lieu à plusieurs reprises. La présence de ce gène chez des bactéries, des champignons et des oomycètes phytopathogènes indique l’importance de ce mécanisme de défense contre le stress oxydant pour ces microorganismes.
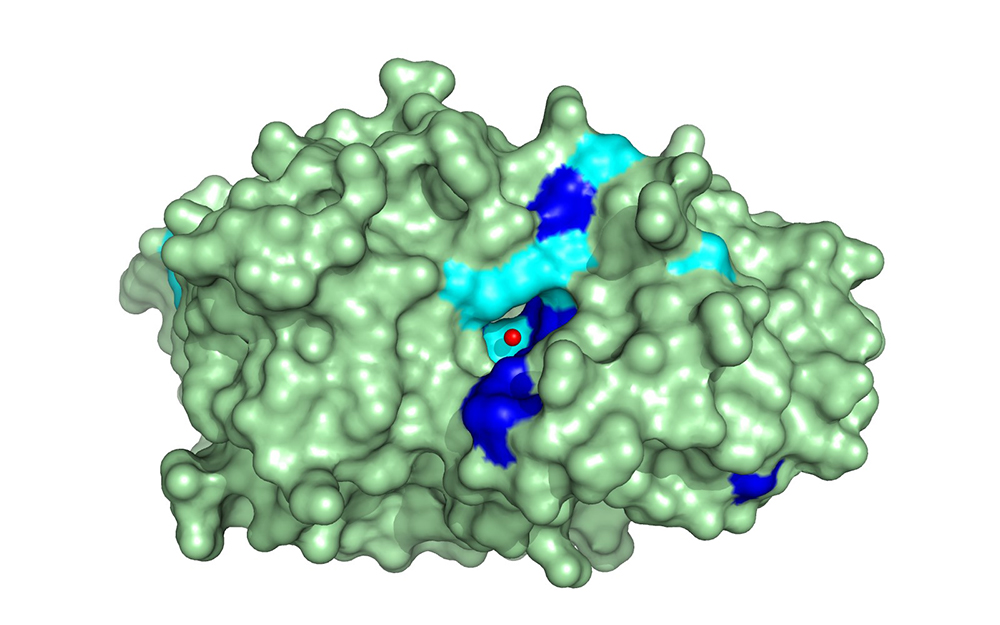
Figure : Structure de la protéine IbpS de Dickeya dadantii. L'atome de fer est représenté par une sphère rouge. Les résidus strictement conservés chez toutes les protéines de la famille sont indiqués en bleu foncés. Ceux conservés à 95 % sont en bleu clair. Les protéines Ibp sont produites par de nombreux microorganismes phytopathogènes, comme par exemple la bactérie Gram négative Pectobacterium atrosepticum ou la bactérie Gram positive Streptomyces scabies, mais aussi par des champignons comme Botrytis cinerea, l’agent de la pourriture grise, et des oomycètes comme Phytophtora infestans, l’agent du mildiou de la pomme de terre.
Pour en savoir plus :
A secreted metal-binding protein protects necrotrophic phytopathogens from reactive oxygen species.
Liu L, Gueguen-Chaignon V, Gonçalves IR, Rascle C, Rigault M, Dellagi A, Loisel E, Poussereau N, Rodrigue A, Terradot L, Condemine G.
Nat Commun. 2019 Oct 24;10(1):4853. DOI : 10.1038/s41467-019-12826-x.