Une nano-machine cellulaire pour rendre un processus morphogénétique irréversible
Il existe un paradoxe apparent en biologie, à savoir que l'élasticité intrinsèque des tissus devrait s’opposer aux forces mécaniques induisant la morphogenèse progressive des organes. Aussi, une déformation permanente ne peut s’observer que s’il existe un mécanisme qui bloque les formes cellulaires dans les états transitoires. Les chercheurs ont pu identifier un tel mécanisme dont ils ont disséqué la micromécanique cellulaire. Ce travail est publié dans la revue Nature.
Cinq sens, dont deux reposant sur des stimuli mécaniques (toucher et ouïe), régissent nos interactions avec l’environnement. De même, nos cellules sont toutes régulièrement soumises à des forces mécaniques externes d’origines variées qui peuvent en modifier la forme, la division, la migration, ou leurs fonctions physiologiques. Plusieurs maladies ainsi que certaines formes de cancer, sont avant tout dues à une mauvaise réponse au stress mécanique. Mieux comprendre comment nos cellules sentent et répondent à ces stimuli mécaniques est donc essentiel.
Afin d'étudier comment les forces mécaniques influencent le comportement des cellules, les chercheurs ont étudié l’élongation embryonnaire du ver Caenorhabditis elegans (C. elegans), facile à étudier in vivo en laboratoire. Au cours de la deuxième partie de son élongation embryonnaire, l’embryon de C. elegans s’étire pour devenir deux fois plus long dans l’axe tête-queue dans un processus impliquant l'apport mécanique extrinsèque de contractions musculaires qui déforment l'épithélium externe (épiderme). Ce processus dure un peu plus d’une heure et a lieu sans division cellulaire. Dans ce contexte les chercheurs ont cherché à comprendre comment les contractions répétées des muscles selon ce même axe tête-queue pouvaient bien favoriser l’allongement progressif de tout l’embryon. En première approximation, l’idée que des déformations répétées de l’épiderme puissent doubler la longueur de l’embryon semblait contradictoire avec le fait qu’un muscle reprend sa forme originelle après une contraction en raison de l’élasticité du système. Leur prédiction a été qu’il pourrait exister un mécanisme permettant de bloquer transitoirement la forme de l’embryon après chaque contraction musculaire.
Pour valider cette prédiction, ils ont développé une démarche expérimentale interdisciplinaire alliant génétique, biologie cellulaire et physique. Ils ont également rationalisé le lien entre déformation et l’élongation de la forme de l’embryon par une modélisation mathématique.
Ce travail a permis d'identifier la nature moléculaire de la machinerie de blocage de la forme. Partant d’une protéine connue pour réguler certaines propriétés mécaniques des cellules (une protéine kinase), les chercheurs ont pu identifier un nouveau partenaire (une protéine du cytosquelette membranaire, l’alpha-spectrine), et montrer que l’absence conjointe de ces deux facteurs conduit l’embryon à s’allonger puis à revenir à sa taille initiale (rétraction). Grâce à des approches génétiques et à l’imagerie à haute résolution in vivo, ils ont établi que ces deux protéines orchestrent la réorganisation du cytosquelette d’actine (réseau intracellulaire conférant rigidité et élasticité à la cellule) de l’épiderme à l’aide de protéines capables de couper puis de coiffer les filaments d’actine. Leurs données suggèrent fortement que ces protéines contrôlant la réorganisation du réseau d’actine permettent de bloquer la forme des cellules selon un processus apparenté à un mécanisme à cliquet (voir figure) et soulignent l'importance de la (visco)-plasticité physique dans la modification de la forme des cellules. L'idée que la plasticité pourrait être importante en biophysique cellulaire est apparue récemment, mais sa base moléculaire n'avait pas encore été caractérisée.
Ces découvertes ont des implications potentielles pour toutes les configurations anatomiques où des cellules contractiles sont en contact avec un épithélium, ce qui est le cas de la plupart de nos organes. Ainsi les contractions des cellules contractiles pourraient, par un processus comparable à celui décrit dans cette étude, influer sur la morphogenèse de l’organe, ou les processus de cicatrisation après blessure. De même, dans la mesure où il est fort probable que des tumeurs apparaissent à côté des cellules qui se contractent, les propriétés des cellules tumorales pourraient s’en trouver modifiées ce qui pourrait augmenter leur invasivité. Ainsi, d'un point de vue mécanique, la caractérisation plus poussée du nanosystème décrit dans ce travail pourrait aider à mieux comprendre la morphogenèse et la tumorigenèse des organes des vertébrés.
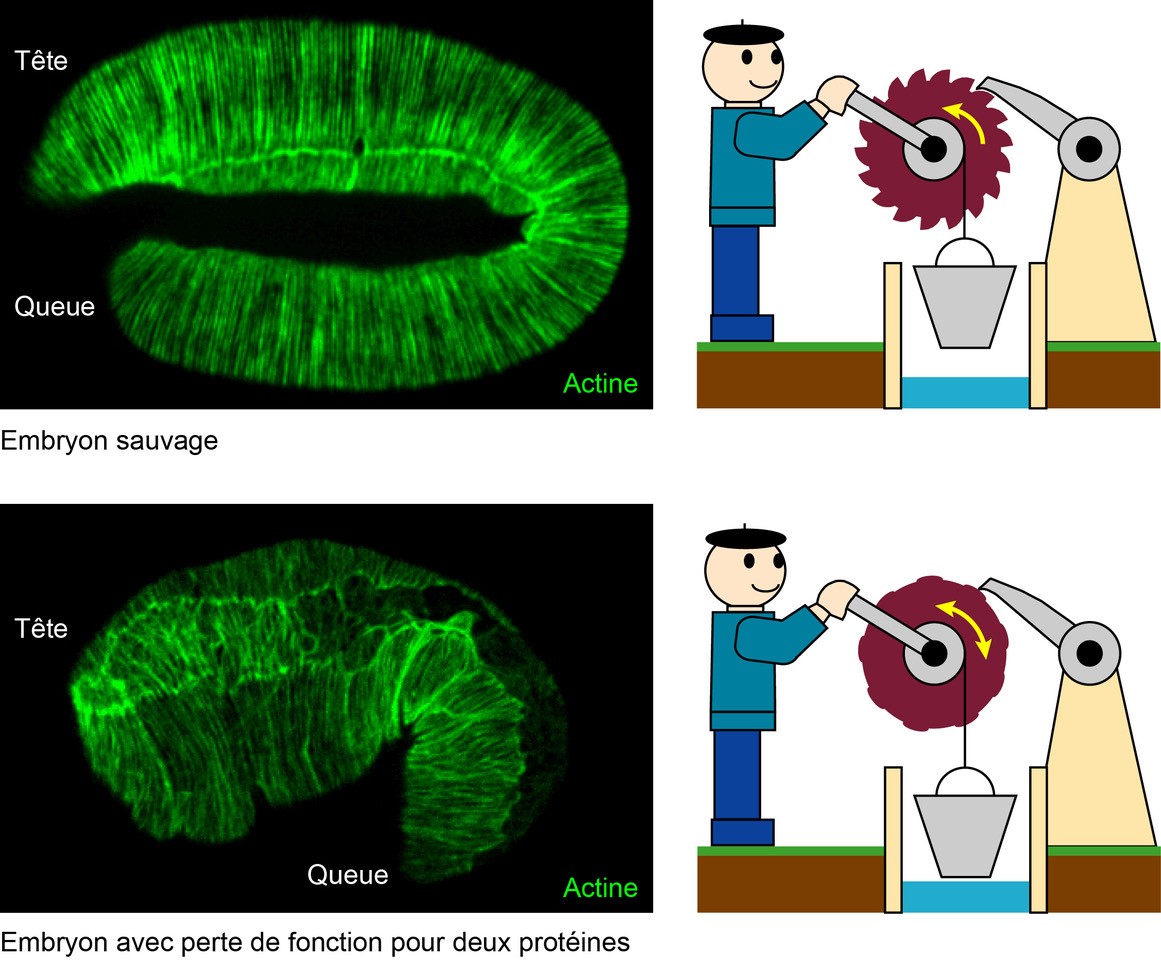
© A. Lardennois & M. Labouesse
En savoir plus :
An actin-based viscoplastic lock ensures progressive body-axis elongation.
Lardennois A, Pásti G, Ferraro T, Llense F, Mahou P, Pontabry J, Rodriguez D, Kim S, Ono S, Beaurepaire E, Gally C, Labouesse M.
Nature. 2019 Aug 28. doi: 10.1038/s41586-019-1509-4. [Epub ahead of print]