Une avancée majeure dans la compréhension des maladies inflammatoires chroniques de l’intestin et du cancer colorectal
L’équipe d’Elisabeth Georges-Labouesse en collaboration avec Michel Labouesse à l’Institut de génétique et de biologie moléculaire et cellulaire, met en lumière le rôle indispensable de l’ancrage des cellules à la matrice extracellulaire pour protéger l’intestin contre l’inflammation et le développement secondaire de cancer dans les maladies inflammatoires chroniques de l’intestin. Ces résultats publiés dans la revue Gut, ouvrent de nouvelles pistes thérapeutiques pour ces maladies.
Les maladies inflammatoires chroniques de l’intestin (MICI), telles que la maladie de Crohn et la rectocolite hémorragique, sont des pathologies invalidantes causées par des inflammations récurrentes du tube digestif à l’origine d’ulcérations de la muqueuse intestinale et de diarrhées sévères. Les patients qui souffrent de MICI présentent un risque élevé de développer un cancer colorectal. En outre, plus la durée de la MICI est longue et l’atteinte intestinale importante, plus ce risque augmente.
Dans les MICI, l’homéostasie intestinale, normalement assurée par la parfaite symbiose entre l’épithélium et son mucus, la flore bactérienne et le système immunitaire, est fortement compromise. La plupart des études sur les MICI fait appel à des modèles de souris, portant ou non une mutation génétique, chez lesquels l’inflammation et le cancer colorectal sont induits grâce à l’utilisation d’agents chimiques. Les modèles dans lesquels ces processus sont spontanés et suivent une progression qui pourrait mimer l’évolution observée chez l’homme sont très rares. En s’intéressant à la connexion entre l’épithélium et la membrane basale, réseau spécialisé de la matrice extracellulaire qui soutient les cellules, les chercheurs de l’IGBMC ont abouti à deux découvertes. Ils ont d’une part, révélé le rôle crucial de ces « fondations » pour protéger l’intestin contre l’inflammation et le cancer. D’autre part, ils ont établi des modèles spontanés de MICI chez la souris ne reposant pas sur un traitement chimique pour déclencher la pathologie.
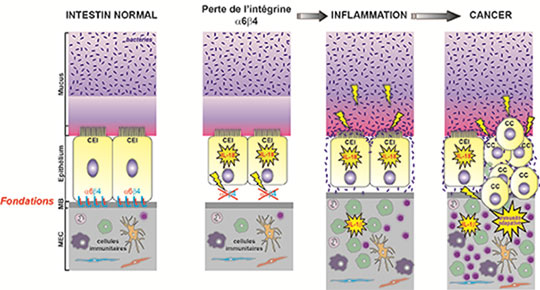
Les cellules épithéliales de notre intestin représentent la première barrière qui assure l’interface avec le contenu intestinal dont la flore bactérienne. Ces cellules sont assises sur une chape nommée matrice extracellulaire, à laquelle elles adhèrent via des récepteurs spécifiques, les intégrines α6β4. Les chercheurs de l’IGBMC, en collaboration avec plusieurs équipes Françaises1 montrent qu’en l’absence de cette intégrine, les cellules épithéliales envoient un signal de stress qui induit une réaction en chaîne, débutant par une inflammation aigüe, qui devient chronique et finit par dégénérer en cancer. C’est la première fois que l’importance de cette chape et de cette assise est démontrée in vivo.
Les souris déficientes pour l’intégrine α6β4 développent en effet une inflammation colorectale chronique dont les lésions dégénèrent spontanément en cancer. La progression de la maladie suit toujours la même séquence d’événements permettant de suivre pas à pas l’ensemble du processus. La perte de l’intégrine entraine tout d’abord un défaut d’ancrage des cellules épithéliales, les rendant plus fragiles et sensibles au stress mécanique (passage de nourriture, contractions musculaires, etc…), ce qui favorise leur détachement de la membrane basale. Ce stress stimule la sécrétion d’une cytokine pro-inflammatoire, l’interleukine-18 (IL-18), sorte de signal d’alarme lancé par les cellules épithéliales avant même que les premiers signes cliniques de l’inflammation ne soient visibles. Cependant, la sécrétion prolongée d’IL-18 affecte progressivement les propriétés de la barrière protectrice de mucus, avec pour conséquence l’établissement d’interactions anormales entre l’épithélium et la flore bactérienne. Ce contact « illicite » avec les bactéries déclenche alors une véritable réaction inflammatoire, assurée par le recrutement massif de cellules de l’immunité innée, qui sécrètent une autre cytokine inflammatoire, l’interleukine-1β (IL-1β). A ce stade, un traitement antibiotique peut limiter la sévérité de l’inflammation. Avec le temps, les lymphocytes et la réaction inflammatoire continue associée à l’immunité adaptative aggravent la pathologie et entrainent la transformation et la progression tumorale des lésions qui évoluent inévitablement en cancer.
Outre sa portée au niveau fondamental, cette découverte offre de nouvelles perspectives pour l’étude des MICI et du cancer colorectal associé à l’inflammation, ouvrant la voie vers le développement de solutions thérapeutiques jusque-là inexplorées.
1 Equipes de M. Chamaillard (Institut Pasteur, Lille), I. Van Seuningen (Centre de Recherche Jean-Pierre Aubert, Lille), S. Robine (Institut Curie, Paris), P. Simon-Assmann (Inserm U1109, Strasbourg) et P. Laquerriere (IPHC, Strasbourg).
En savoir plus
-
Hemidesmosome integrity protects the colon against colitis and colorectal cancer.
* Cet article est un hommage à la mémoire d’Elisabeth Georges-Labouesse qui est décédée en Juillet 2012 et a conçu ce projet de recherche.
De Arcangelis A, Hamade H, Alpy F, Normand S, Bruyère E, Lefebvre O, Méchine-Neuville A, Siebert S, Pfister V, Lepage P, Laquerriere P, Dembele D, Delanoye-Crespin A, Rodius S, Robine S, Kedinger M, Van Seuningen I, Simon-Assmann P, Chamaillard M, Labouesse M, Georges-Labouesse E*.
Gut. 2016 Jul 1. pii: gutjnl-2015-310847. doi: 10.1136/gutjnl-2015-310847.