Une armure en sucre module les échanges génétiques entre bactéries
La capsule bactérienne est une enveloppe composée de sucres qui protège les pathogènes contre le système immunitaire, notamment les espèces nosocomiales résistantes aux antibiotiques. Cette étude, parue dans la revue PLOS Biology, combinant génomique comparative et transferts génétiques in vitro révèle que l’interaction entre la capsule et les éléments génétiques mobiles module l’acquisition de nouveaux gènes par les bactéries, dont les gènes de résistance aux antibiotiques.
Les éléments génétiques mobiles sont à l'origine de transferts de gènes entre bactéries, et conduisent à l’acquisition de facteurs de virulence et de résistance aux antibiotiques à travers le monde. Ces éléments mobiles, tels que les virus bactériens, ou bactériophages, et les plasmides conjugatifs, interagissent physiquement avec l’enveloppe bactérienne. Chez les pathogènes nosocomiaux multi-résistants comme Klebsiella pneumoniae, l’enveloppe est protégée par la capsule, une épaisse structure composée de sucres. Sa composition chimique diffère selon les gènes constituant le "locus capsulaire", ce qui donne lieu à de nombreux sérotypes capsulaires. Si la capsule semble de prime abord constituer une barrière physique à l’entrée des éléments mobiles, elle évolue en fait rapidement par transfert horizontal de gènes, grâce à l’acquisition d’éléments mobiles.
Pour comprendre cette apparente contradiction, les scientifiques ont tout d’abord étudié le flux des gènes transférés chez K. pneumoniae. Pour cela, ils ont reconstruit l’histoire des acquisitions et pertes de gènes parmi quatre mille génomes de Klebsiella. Les résultats montrent que les bactériophages, qui peuvent contenir et transférer des gènes de leur précédent hôte, sont majoritairement spécifiques d'un sérotype capsulaire, ce qui favorise les échanges génétiques au sein d’un même groupe de bactéries.
Cependant, des formes résistantes à l'infection phagique, non-capsulées, émergent rapidement lorsque la prédation par les bactériophages est forte. Cette résistance par inactivation de la capsule bloque aussi l’acquisition de nouveaux gènes par le biais des bactériophages.
L’étude détaillée des génomes des bactéries non-capsulées suggère que l’absence de la capsule augmente le taux d’acquisition de nouveaux gènes par un autre mécanisme de transfert de gènes : la conjugaison. Le test expérimental de cette observation a confirmé que la diminution du taux d’acquisition de nouveaux gènes par les bactériophages peut être largement compensée par l’acquisition accrue par conjugaison. Même si ces souches non-capsulées sont typiquement moins virulentes, les plasmides conjugatifs sont les principaux vecteurs de gènes de résistance aux antibiotiques à travers le monde. Ainsi l’inactivation de la capsule protège des virus et peu rendre moins virulent, mais facilite l’acquisition de gènes de résistance aux antibiotiques par d'autres voies. Sur le long terme, les bactéries peuvent réacquérir la capsule et redevenir virulentes en restant résistantes aux antibiotiques.
Les auteurs de l’étude proposent donc un nouveau modèle d’évolution dans lequel les cycles de perte/réacquisition de la capsule permettent aux bactéries d’échantillonner différentes sources de gènes dans leur communauté. Il existerait un compromis entre l'évolution de la virulence chez les formes capsulées, et de la multi-résistance chez les bactéries non-capsulées. Ainsi, certaines alternatives aux antibiotiques, comme l’utilisation de bactériophages ou des vaccins ciblant uniquement la capsule, pourraient sélectionner des bactéries non-capsulées certes moins virulentes, mais plus à même d’acquérir de nouvelles résistances aux antibiotiques puis une capsule fonctionnelle d’un nouveau sérotype.
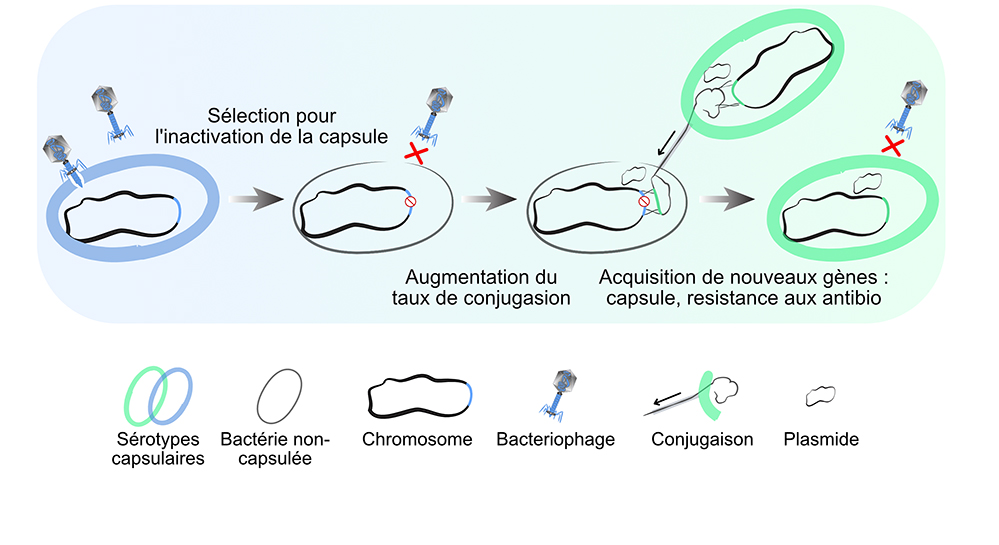
Figure : Cycle inactivation/réactivation de la capsule. L'inactivation de la capsule est occasionnellement adaptative, comme lors de la prédation par les bactériophages qui sont spécifiques au sérotype de la capsule. Les souches non-capsulées sont protégées des infections par les bactériophages, tout en acquérant davantage de gènes par conjugaison. Cela augmente la probabilité de ré-acquisition de la capsule, et de gènes de résistance aux antibiotiques. Lorsque la capsule acquise est d’un nouveau sérotype, la bactérie est aussi résistante aux précédents bactériophages.
Pour en savoir plus :
Interplay between the cell envelope and mobile genetic elements shapes gene flow in populations of the nosocomial pathogen Klebsiella pneumoniae.
Haudiquet M, Buffet A, Rendueles O, Rocha EPC
Plos Biology, 6 juillet 2021. https://doi.org/10.1371/journal.pbio.3001276
Contact
laboratoire
Laboratoire de génomique évolutive des microbes (Institut Pasteur/CNRS)
28 rue du docteur Roux
75015 Paris FRANCE