Un tandem protéique assure l’alpha et l’oméga de la division des ovocytes
Chez les animaux, les cellules reproductrices femelles, les ovocytes, sont arrêtées dans leur différenciation au sein des ovaires pendant de très longues périodes (mois ou années chez les vertébrés). Cette pause est essentielle car, en son absence, la croissance de l’ovocyte ne bénéficie pas de suffisamment de temps, produisant des gamètes trop petits et incapables de former un embryon. Dans un article publié dans Nature Communications, les scientifiques révèlent les mécanismes moléculaires assurant cet arrêt et sa levée lors de l’ovulation, permettant à l’ovocyte de reprendre son évolution en gamète.
Chez les Vertébrés, la pause ovocytaire est dûe à une kinase (enzyme qui phosphoryle les protéines) appelée PKA. Mais il faudra attendre près de 40 ans pour que soit identifiée Arpp19, la protéine phosphorylée par PKA et responsable de l’arrêt de l’ovocyte. Lors de l’ovulation, une hormone (la progestérone chez l’amphibien utilisé dans cette étude) agit sur l’ovocyte et provoque la déphosphorylation d’Arpp19. Cette nouvelle forme d’Arpp19 lève le blocage en déclenchant une cascade d’interactions entre molécules qui se conclut 4 heures plus tard par l’activation de l’enzyme-clé de la division, Cdk1. Cette dernière entraîne les divisions de l’ovocyte (appelées divisions méiotiques), étape finale de sa différenciation en gamète.
Les scientifiques montrent qu'en réponse à la progestérone, Arpp19 passe de l’état phosphorylé à l’état déphosphorylé (ce qui lève le blocage de l’ovocyte) sous l'effet de la phosphatase PP2A-B55d (les phosphatases sont des enzymes qui déphosphorylent les protéines) . Pourtant, il est surprenant de noter que,dans l’ovocyte bloqué, PP2A-B55d est active, comme PKA. Néanmoins, Arpp19 reste sous son état phosphorylé. Cet apparent paradoxe s'explique par le fait que la kinase PKA est beaucoup plus active que la phosphatase, entraînant un turn-over de phosphorylation/déphosphorylation d’Arpp19 pendant toute la période d’arrêt. Ce système, très couteux sur le plan énergétique pour la cellule, permet aux deux enzymes, actives, de modifier d’autres substrats qu’Arpp19 importants pour la vie ovocytaire.
Les scientifiques montrent également comment la progestérone provoque la bascule de cet équilibre : l’activité de PKA est brutalement inhibée, ce qui stoppe la phosphorylation d’Arpp19 alors que celle de PP2A-B55d n’est pas affectée. Toujours active, cette dernière déphosphoryle Arpp19 qui déclenche alors la reprise de la différenciation ovocytaire.
Enfin, de manière surprenante, 4 heures après que le duo Arpp19/PP2A-B55d a déclenché le réveil de l’ovocyte, il se retrouve à jouer un rôle moléculaire tout-à-fait différent dans l’activation de Cdk1 qui lance les divisions méiotiques de l’ovocyte, qui aboutiront à la production finale du gamète. Un même couple de protéines assure donc le réveil de l’ovocyte puis, 4 heures plus tard, sa division, deux étapes-clefs dans la différenciation de l’ovocyte en gamète! Cela ouvre de nouvelles voies de recherche ou de thérapie sur la division cellulaire et la biologie des cellules reproductrices.
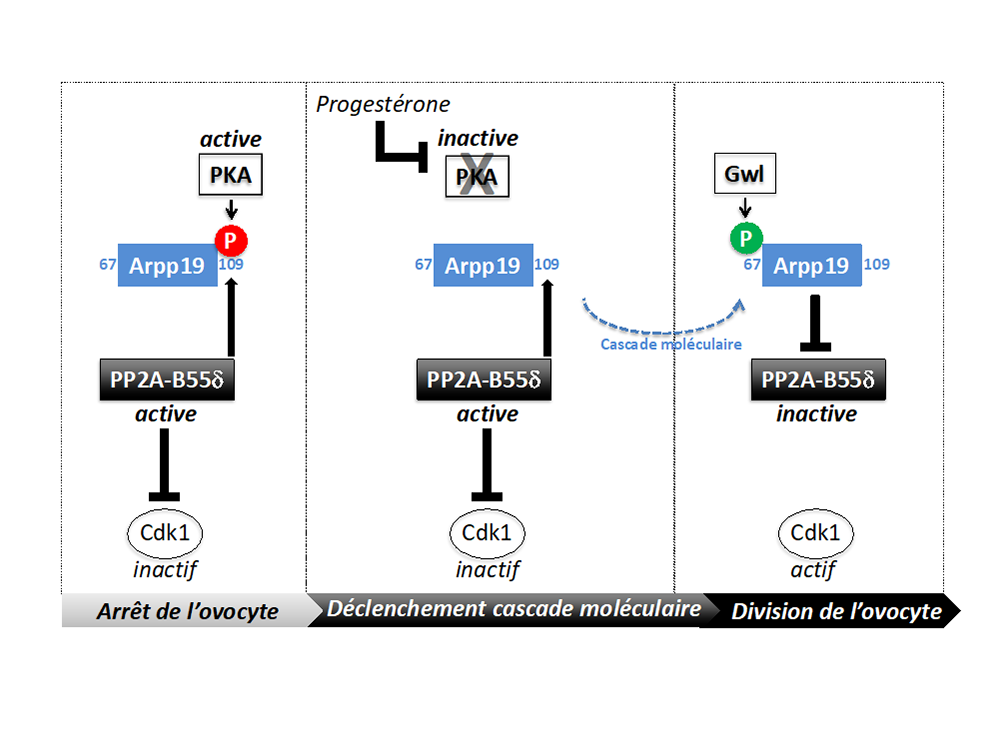
Figure : À gauche : L’arrêt de l’ovocyte est assuré par une forte activité PKA qui domine celle de son enzyme antagoniste, PP2A-B55 d, et maintient Arpp19 phosphorylée en position 109. Au centre : la progestérone inhibe PKA. L’activité de PP2A-B55d n’est pas affectée et, n’étant plus contrebalancée par PKA, déphosphoryle Arpp19. Sous cette forme, Arpp19 déclenche une cascade moléculaire de plusieurs heures. À droite : la cascade aboutit à une nouvelle phosphorylation en position 67 d’Arpp19, par une kinase appelée Greatwall (Gwl). Sous cette forme, Arpp19 inhibe PP2A-B55d. Ceci permet l’activation de Cdk1, l’enzyme-maître de la division cellulaire.
Pour en savoir plus :
The M-phase regulatory phosphatase PP2A-B55δ opposes protein kinase A on Arpp19 to initiate meiotic division.
Lemonnier T, Daldello EM, Poulhe R, Le T, Miot M, Lignières L, Jessus C, Dupré A.
Nat. Commun. 23 mars 2021, .https://doi.org/10.1038/s41467-021-22124-0
Contact
laboratoire
Laboratoire de Biologie du Développement—Institut de Biologie Paris Seine (Sorbonne Université – CNRS)
9 quai Saint Bernard
75005 Paris
