Un nouvel acteur moléculaire qui fait pencher le cœur à gauche
La mise en place de l’asymétrie droite-gauche est essentielle pour le développement et la fonction d’organes tels que le cœur et le tractus gastro-intestinal. Les mécanismes qui orchestrent ce processus restent mal compris. Dans un article publié dans la revue Nature Communications, des scientifiques montrent, chez le poisson zèbre, le rôle crucial d’une protéine, la Myosine1G, dans cette mise en place.
Des asymétries droite-gauche indispensables au bon fonctionnement de l’organisme.
En dépit d’une apparente symétrie extérieure, le corps humain présente de nombreux organes internes caractérisés par des asymétries droite-gauche en termes de positionnement et de morphologie. Le positionnement du cœur sur la gauche est essentiel pour le fonctionnement du système cardiovasculaire alors que l’enroulement directionnel de l’intestin est indispensable pour le transit intestinal. Des défauts dans la mise en place de ces asymétries peuvent engendrer des conséquences pathologiques sévères allant d’occlusions intestinales causant la mort du fœtus à l’apparition de troubles cardiaques chez l’adulte. La compréhension des mécanismes régissant la mise en place de l’asymétrie droite-gauche relève donc d’un intérêt fondamental aussi bien que biomédical.
Au cours des 20 dernières années, le poisson zèbre est apparu comme modèle majeur de la recherche biomédicale pour l’étude de la mise en place de l’asymétrie droite-gauche. Au-delà du fait que la grande majorité des gènes humains ont un équivalent chez le poisson zèbre, les embryons du poisson zèbre ont la particularité d’être transparents, ce qui permet de visualiser aisément le positionnement de différents organes tels que le cœur sur le côté gauche de l’animal.
Chez le poisson zèbre comme chez l’homme, le développement de l’asymétrie droite-gauche a lieu en trois étapes : Premièrement, la mise en place d’un organe appelé « organisateur droite-gauche » dont le rôle est de déterminer le côté gauche de l’animal. Deuxièmement, la production de molécules de signalisation appelées « Nodal » qui sont d’abord exprimées au niveau de l’organisateur droite-gauche et se propagent ensuite sur le côté gauche de l’animal afin de transmettre l’information biologique « gauche » à différents tissus cibles tels que les viscères, le cœur et le cerveau. Troisièmement, l’exécution du développement asymétrique au niveau de différents organes, tel que le cœur dont le primordium initialement symétrique est transformé en tube pointant vers la gauche de l’embryon.
La Myosine 1G, un moteur moléculaire qui transporte les molécules porteuses de l’information « gauche »
Dès 2018, l’utilisation de ce modèle d’étude a permis d’identifier le gène Myosine1D comme régulateur essentiel de la première étape de ce processus, c.à.d. la mise en place de l’organisateur droite-gauche. De manière particulièrement intéressante, différentes études ont révélé que la fonction de Myosine1D est conservée de la mouche drosophile au poisson zèbre et jusqu’à l’homme. Au-delà du gène codant pour la Myosine1D, le génome du poisson zèbre encode (de même que le génome humain) la protéine étroitement apparentée Myosine1G. Une nouvelle étude parue dans la revue Nature Communications montre que la Myosine1G est également importante pour le développement de l’asymétrie droite-gauche, mais que son rôle est différent de celui de Myosine1D. Myosine1G est en effet nécessaire pour la signalisation Nodal, dont le rôle est de transmettre l’information « gauche », de l’organisateur droite-gauche aux différents tissus cibles. Chez des embryons pour lesquels le gène myosine1g a été inactivé, la capacité du gène Nodal southpaw d’induire sa propre expression sur le côté gauche de l’animal est réduite ce qui fait que son expression se limite à la partie postérieure de l’embryon et n’atteint jamais les organes antérieurs (cœur et cerveau) qui présentent alors des défauts d’asymétrie. Des analyses par microscopie montrent que Myosine1G agit comme moteur moléculaire responsable du transport de différents composants de la voie de signalisation Nodal au sein des cellules de l’embryon de poisson zèbre.
Le développement embryonnaire et la bonne santé de l’organisme adulte reposent tous deux sur une régulation minutieuse de la voie de signalisation Nodal. Des niveaux d’expression excessifs de Nodal ont par exemple été liés au développement de cancers de la peau (mélanomes). Les résultats obtenus par les scientifiques révèlent que Myosine1G, au-delà de son rôle crucial dans l’asymétrie droite-gauche, pourrait également réguler la signalisation Nodal dans d’autres contextes biologiques. Ces découvertes ouvrent ainsi de nouvelles perspectives de recherche pour explorer l’implication de Myosine1G dans divers contextes pathophysiologiques.
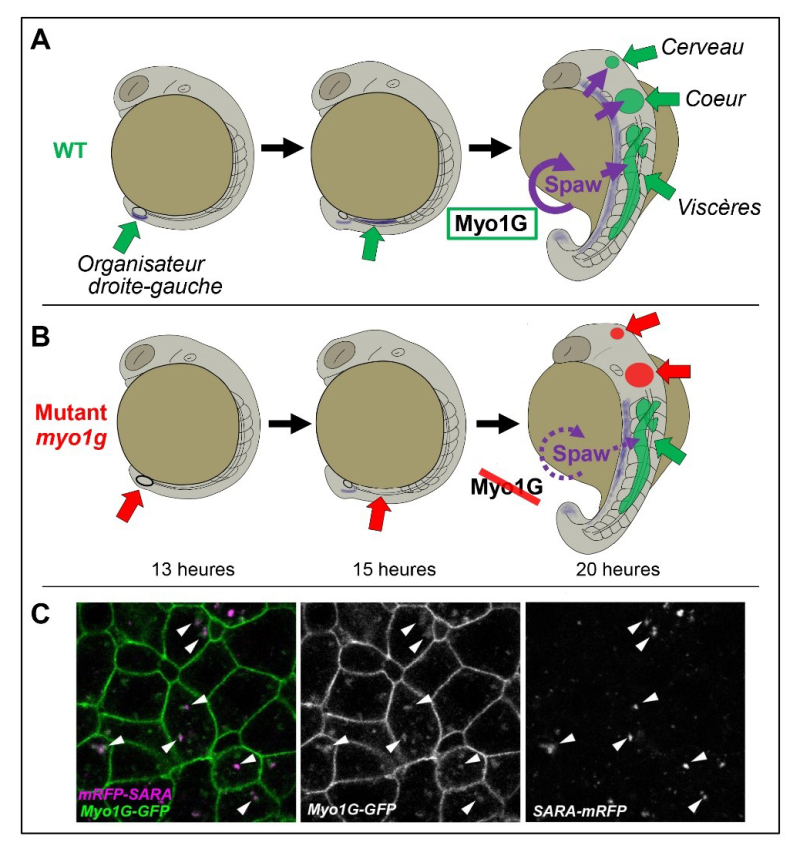
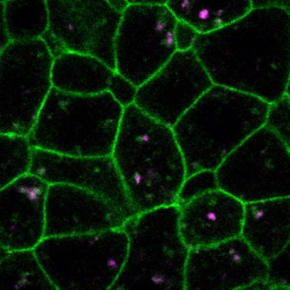
Figure : La Myosine1G contrôle l’asymétrie droite-gauche en régulant la signalisation par le ligand Nodal Southpaw (Spaw). A : Chez l’embryon de poisson zèbre sauvage (WT), Spaw s'exprime d'abord dans la partie postérieure de l’animal, au niveau de l’organisateur droite-gauche. Vers 15 heures de développement, Spaw commence à se propager du postérieur vers l’antérieur en induisant sa propre expression (hachures violettes) sur le côté gauche de l’animal. Vers 20 heures de développement, Spaw est ainsi exprimé le long du côté gauche de l’embryon (indiqué par des hachures violettes sur la figure) ce qui permet à cette molécule de signalisation de contrôler la morphogénèse asymétrique des organes postérieurs (viscères) aussi bien que antérieurs (cœur & cerveau). B : Dans les embryons mutants pour myosine1g, l’auto-induction de l'expression de Spaw est limitée et son expression n'atteint donc jamais les organes antérieurs, entraînant des défauts d'asymétrie du cœur et du cerveau. C : Les images montrent que la Myosine1G (Myo1G-GFP) est associée à des vésicules intracellulaires (flèches) contenant SARA (mRFP-SARA), une molécule participant à la signalisation Nodal.
En savoir plus : Kurup, A.J., Bailet, F. & Fürthauer, M. Myosin1G promotes Nodal signaling to control zebrafish left-right asymmetry. Nat Commun 15, 6547 (2024). https://doi.org/10.1038/s41467-024-50868-y
Contact
Laboratoire
Institut de biologie Valrose - iBV (CNRS/Inserm/Université Côte d’Azur)
28 Avenue Valrose
F-06108 Nice cedex 2