Un nouveau transporteur lysosomal qui met les bouchées doubles pour recycler les acides aminés
Dans une étude publiée dans la revue Nature Cell Biology, des scientifiques relatent la structure et la fonction d’un nouveau transporteur de la membrane du lysosome. Ils montrent que ce transporteur ouvre une nouvelle voie de recyclage des acides aminés vers les biosynthèses cellulaires lorsque les transporteurs lysosomaux d'acides aminés sont surchargés.
Une usine de recyclage au cœur de la cellule
Les tissus vivants se renouvellent en permanence. De nouvelles cellules remplacent les anciennes dans la plupart des tissus, mais pas tous, et des processus de maintenance renouvellent les composants des cellules en éliminant les composants usagés et en les recyclant. Ce mécanisme est très important dans les cellules à longue durée de vie, comme les neurones. Un organite intracellulaire, le lysosome, joue un rôle essentiel dans ces processus de maintenance en fusionnant avec les compartiments dans lesquelles les composants défectueux et les débris cellulaires ont été séquestrés ou internalisés. Cette fusion libère dans ces compartiments des hydrolases, qui dégradent les macromolécules ainsi isolées en briques élémentaires : acides aminés, sucres, acides gras, nucléosides, etc. Ces briques sont ensuite exportées du lysosome par des transporteurs membranaires pour être réutilisés dans de nouvelles synthèses cellulaires. Ce mécanisme de dégradation et recyclage sert aussi à adapter les cellules à des situations de stress, comme les carences nutritionnelles. Les connaissances actuelles sur les mécanismes de transport à travers la membrane lysosomale essentiels au recyclage restent limitées car on ne connaît qu’une partie des transporteurs impliqués. Pour ce qui concerne les protéines, il était admis jusqu’ici que leur dégradation lysosomale devait être complète, c’est-à-dire qu’elle libère leurs composants élémentaires, les acides aminés, pour permettre le recyclage.
Découverte d’un nouveau transporteur lysosomal
L’étude publiée dans Nature Cell Biology relate la découverte d’un nouveau transporteur lysosomal qui présente une sélectivité atypique pour des dipeptides, c’est-à-dire des « paires » d’acides aminés, plutôt que pour des acides aminés individuels.
Les scientifiques ont utilisé une multiplicité d’approches pour caractériser ce transporteur, formé d’un complexe de deux protéines appelées MFSD1 et GLMP. Tout d’abord ils ont purifié des lysosomes de souris déficientes en protéine MFSD1. L’analyse « métabolomique » par spectrométrie de masse a révélé une accumulation de deux dipeptides en l’absence de MFSD1, mettant les scientifiques sur la piste de sa fonction de transport. Une étude approfondie de la protéine purifiée ou exprimée dans des modèles cellulaires a ensuite permis de démontrer sa capacité à lier et transporter des dipeptides. Ces travaux ont révélé qu’il s’agit d’un transporteur général de dipeptides, capable de transporter une grande diversité de dipeptides. Enfin, la caractérisation par cryomicroscopie électronique du complexe formé par MFSD1 avec sa sous-unité accessoire GLMP a permis d’établir la structure tridimensionnelle de ce complexe à l’échelle atomique. Des expériences de modélisation moléculaire, ont ensuite permis de comprendre les bases structurales de sa sélectivité générale, mais stricte, vis-à-vis des dipeptides en montrant comment ces molécules sont « tenues » par leurs extrémités dans le site de liaison.
En évacuant les briques élémentaires du lysosome deux par deux, le complexe MFSD1/GLMP met en quelque sorte les bouchées doubles pour recycler les protéines usagées car les dipeptides exportés du lysosome sont rapidement clivés en acides aminés par des enzymes cellulaires. La caractérisation de MFSD1/GLMP révèle donc une nouvelle voie de recyclage des acides aminés, qui pourrait intervenir lorsque les transporteurs lysosomaux d'acides aminés sont surchargés, par exemple lors de réponses à des stress cellulaires.
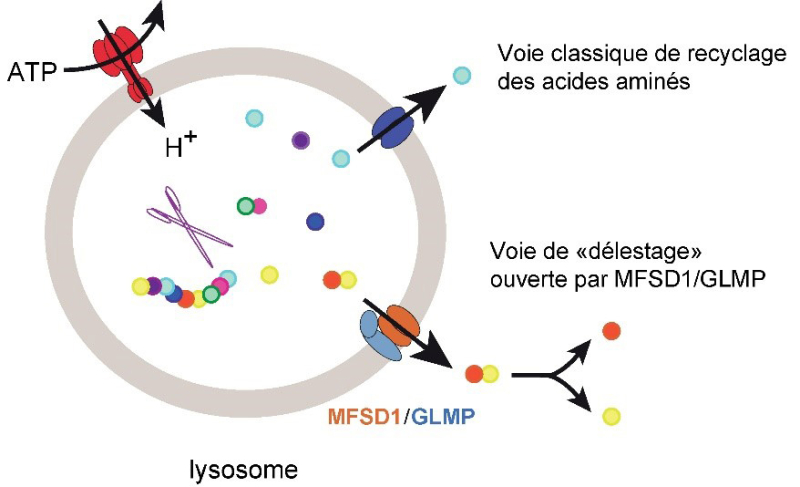
Figure : Le complexe MFSD1/GLMP exporte une grande diversité de dipeptides à travers la membrane lysosomale, qui sont ensuite clivés en deux par des aminopeptidases cytosoliques. Cette nouvelle activité de transport lysosomal ouvre donc une nouvelle voie de recyclage des acides aminés, qui pourrait intervenir lorsque les transporteurs d’acides aminés simples sont saturés.
En savoir plus : Jungnickel, K.E.J., Guelle, O., Iguchi, M. et al. MFSD1 with its accessory subunit GLMP functions as a general dipeptide uniporter in lysosomes. Nat Cell Biol (2024). https://doi.org/10.1038/s41556-024-01436-5
Contact
Laboratoire
Institut des Neurosciences Paris Saint-Pères - SPPIN (CNRS/Université Paris cité)
Equipe Dynamique Membranaire
45 rue des Saints-Pères
75006 Paris