Un nouveau modèle bactérien pour étudier le chaperon moléculaire essentiel Hsp90
Les chaperons moléculaires aident au bon repliement des protéines. Indispensable chez les eucaryotes, le chaperon Hsp90 était décrit comme non essentiel chez les bactéries. Des chercheurs du Laboratoire de bioénergétique et ingénierie des protéines montrent que Hsp90 est indispensable en condition de stress chez la bactérie aquatique modèle Shewanella oneidensis. Ceci a permis d’identifier une nouvelle protéine indispensable cible d’Hsp90 et ouvre de nouvelles perspectives pour comprendre le rôle et le mécanisme d'action de ce chaperon. Cette étude a été publiée le 25 avril 2017 dans la revue Cell Reports.
Dans toutes les cellules vivantes, le repliement correct des protéines (aussi appelé protéostasie) est primordial pour le fonctionnement cellulaire. Cependant, les protéines sont soumises en permanence à de nombreux stress (température, stress oxydants, etc.) qui altèrent leur bon repliement. Un dérèglement de la protéostasie conduit à de nombreuses maladies (maladies neurodégénératives, cancers, etc.) et même à la mort cellulaire. Pour pallier ces problèmes, les chaperons moléculaires constituent une classe de protéines très conservées des bactéries à l’homme. Ils aident au maintien de la protéostasie et assistent les autres protéines depuis leur synthèse jusqu'à leur dégradation.
Le chaperon Hsp90 (pour « Heat Shock Protein 90kDa ») est présent chez la plupart des organismes. Chez les eucaryotes, Hsp90 est essentiel et permet le repliement et l’activation de plus de 300 protéines cibles appelées clientes. Cependant, Hsp90 aide aussi au repliement d’oncoprotéines dans les cellules cancéreuses et il est donc logiquement devenu une cible de choix dans le traitement de cancers. Cependant, malgré un grand nombre d’études, le fonctionnement moléculaire précis d’Hsp90 n’est toujours pas connu et de nouveaux angles d’approche sont donc nécessaires pour décortiquer son mécanisme d’action.
Chez les bactéries, le rôle d’Hsp90 est très peu documenté. Jusqu’à présent, Hsp90 était décrit comme non essentiel chez les protéobactéries et très peu de cibles d’Hsp90 bactériens ont été identifiées. Les chercheurs ont étudié Shewanella oneidensis, une bactérie aquatique qui possède une très grande capacité d’adaptation. Ils ont découvert que la survie de S. oneidensis lors d’un stress thermique dépend de la présence d’Hsp90. Ainsi, comme chez les eucaryotes, Hsp90 est essentiel chez cette bactérie. Ce résultat tout à fait novateur leur a permis grâce à une approche génétique suivie d'analyses biochimiques, d’identifier une nouvelle protéine cliente (TilS). Cette protéine indispensable est impliquée dans la maturation d’ARNs de transfert, des molécules permettant la synthèse des protéines.
Ces découvertes font sauter un verrou majeur dans les recherches sur les chaperons Hsp90 d’origine bactérienne et ouvrent un vaste champ d'investigations pour comprendre le fonctionnement d’Hsp90 en utilisant ce nouveau modèle bactérien. Ainsi, de nouvelles régions fonctionnelles d’Hsp90 pourront être facilement caractérisées et de nouveaux clients pourront être identifiés. Cette bactérie pourrait aussi être utilisée pour tester à grande échelle des collections de molécules inhibitrices d’Hsp90 potentiellement actives dans la lutte contre les cancers. Enfin, à la lumière de cette étude, Hsp90 pourrait aussi se révéler essentiel chez des bactéries pathogènes et son inhibition conduire à de nouvelles classes d’antibiotiques.
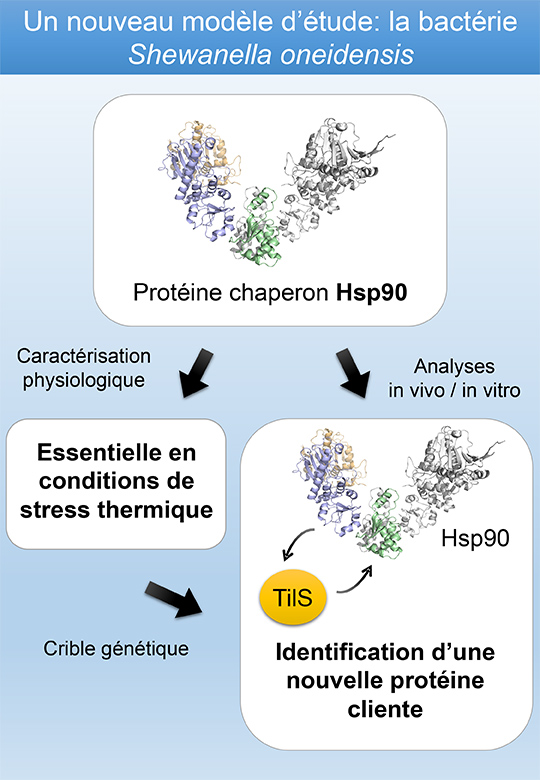
© Flora Ambre Honoré, Vincent Méjean, Olivier Genest
En savoir plus
-
Hsp90 Is Essential under Heat Stress in the Bacterium Shewanella oneidensis.
Honoré FA, Méjean V, Genest O.
Cell Rep. 2017 Apr 25;19(4):680-687. doi: 10.1016/j.celrep.2017.03.082.