Un nouveau mécanisme impliqué dans la dégradation de la cellulose par un champignon phytopathogène
Dans un article publié dans la revue PNAS, les scientifiques décrivent un mécanisme utilisé par un champignon phytopathogène permettant de « booster » la dégradation de la cellulose, lors de l’infection de la plante. La découverte de ce processus pourrait ouvrir la voie à la production de nouveaux cocktails enzymatiques pour dégrader la cellulose, un polymère très abondant sur terre et source d’énergie mais très récalcitrant à la dégradation.
Les champignons pathogènes des plantes (phytopathogènes) ont la capacité de dégrader la paroi végétale contenant de la cellulose lors du processus d’infection. Certaines des enzymes impliquées dans la dégradation de la cellulose présentent des particularités qui ont attirées l’attention des scientifiques. En effet, ces enzymes présentent des régions qui sont « intrinsèquement désordonnées », à savoir dépourvues d’une structure tridimensionnelle unique et précise. Ces régions, possédant une structure qui change en permanence, sont cependant capables d’exercer une fonction biologique qui repose précisément sur cette absence de structure fixe. Leur malléabilité leur offre la possibilité d’établir des interactions avec de nombreux partenaires, et cette promiscuité leur permet d’exercer des fonctions de régulation dans de nombreux processus biologiques.
Etudier une maladie fongique très répandue qui impacte considérablement le rendement des cultures maraichères, fruitières et céréalières
Une analyse bioinformatique exhaustive, portant sur 27 060 séquences de ces enzymes appelées LPMOs (pour Lytic Polysaccharide MonoOxygenases), avait révélé que ces appendices désordonnés étaient très répandus chez ces enzymes. La prévalence de ces régions désordonnées, dont la fonction était inconnue et négligée par la communauté scientifique, dans des enzymes provenant d'organismes très divergents sur le plan de l'évolution laissait présager d’un rôle fonctionnel important. Les scientifiques ont alors entrepris l’étude de ces régions énigmatiques chez les champignons phytopathogènes du genre Colletotrichum, responsables de l'anthracnose, une maladie fongique très répandue qui impacte considérablement le rendement des cultures maraichères, fruitières et céréalières. Pour pénétrer dans les tissus végétaux, ces champignons ont évolué depuis plusieurs centaines de millions d'années de manière à acquérir la capacité de dégrader des polymères comme la cellulose. Pour cela, ils utilisent des enzymes spécialisées, telles que les LPMOs.
Au cours de cette étude, les scientifiques ont focalisé leur attention sur les enzymes LPMOs appartenant à la famille AA9 du champignon Colletotrichum orbiculare. Grâce à une approche bioinformatique, les régions prédites comme désordonnées à l’une des extrémités de ces LPMOs ont pu être identifiées et deux de ces enzymes ont ensuite été sélectionnées pour étudier ces extensions énigmatiques. Ces deux enzymes fongiques ont ensuite été produites par voie recombinante chez la levure, un organisme capable de fabriquer des protéines similaires, voire identiques, à celles produites par Colletotrichum. La nature désordonnée de ces régions a été confirmée à l’aide de méthodes biophysiques telle que la diffusion des rayons X aux petits angles, une technique particulièrement adaptée à l’étude de systèmes flexibles.
De nouveaux cocktails enzymatiques pour dégrader plus efficacement la cellulose
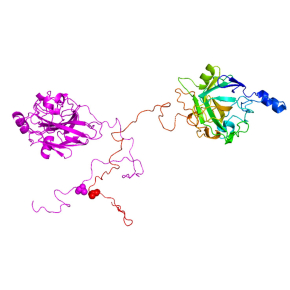
De manière totalement inattendue, ces enzymes se sont avérées être capables de dimériser et les scientifiques ont montré que ce processus de dimérisation confère des propriétés accrues à ces enzymes en termes de liaison au substrat et d’activité sur la cellulose. La dimérisation repose sur la formation d’un pont disulfure impliquant un résidu de cystéine localisé dans l’extension désordonnée. Ainsi, ces régions désordonnées, qui auparavant étaient systématiquement éliminées avant toute étude structurale et fonctionnelle portant sur des LPMOs, se sont avérées être bien plus que des simples appendices et essentielles pour la formation de dimères d’enzyme ayant une activité enzymatique plus élevée par rapport à la forme monomérique.
Les résultats obtenus montrent également que le processus de dimérisation n’est pas un simple artefact se produisant dans un tube à essai contenant l’enzyme purifiée, puisque ce processus a lieu également chez le champignon C. orbiculare, où cette enzyme est effectivement secrétée sous forme de dimère au cours de l’infection. Les scientifiques ont ensuite décrypté le rôle de cette enzyme dans le mécanisme de pénétration de la plante : l’élimination de cette enzyme chez C. orbiculare entraîne un défaut dans la formation de l’appressorium, à savoir la structure spécialisée pour la pénétration des tissus végétaux.
En outre, les scientifiques ont montré que la capacité de dimériser n’est pas une propriété unique aux LPMOs de C. orbiculare, et est observée également chez d’autres champignons du genre Colletotrichum. L’ensemble des découvertes issues de cette étude illustre la capacité des champignons de s’adapter à leur environnement en produisant des enzymes capables de dégrader des polymères récalcitrants et ouvre la voie au développement de nouveaux cocktails enzymatiques pour dégrader plus efficacement la cellulose.
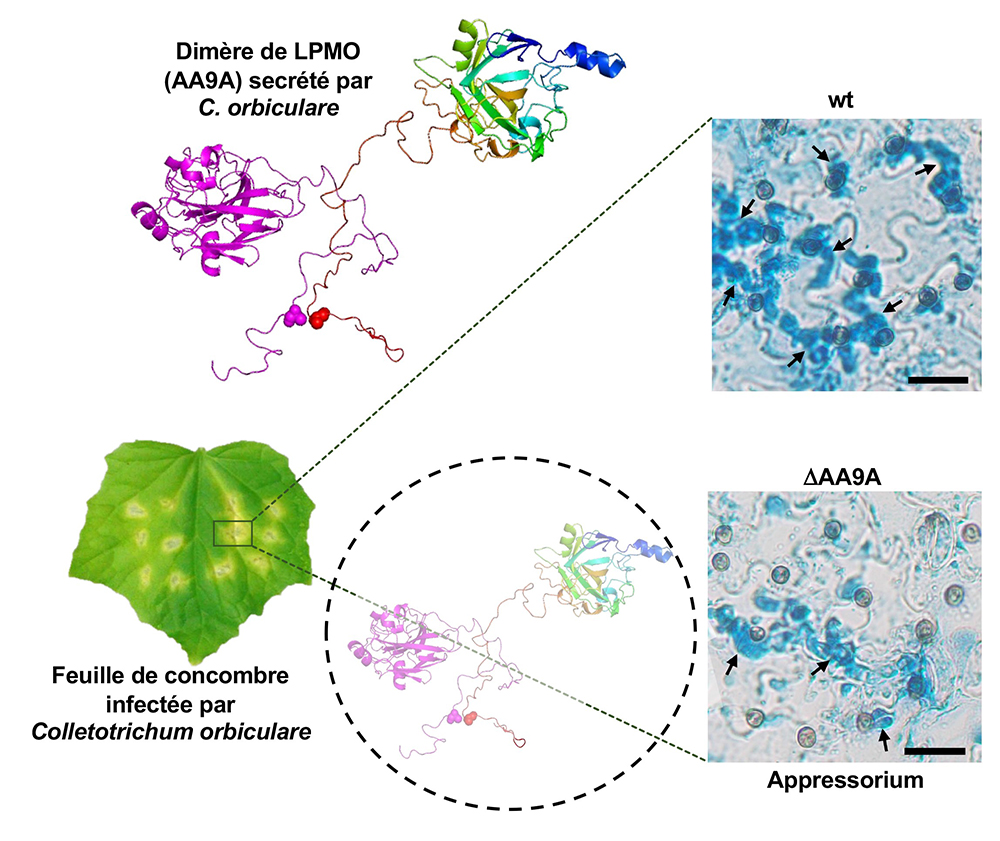
Figure : Feuille de concombre infectée par le champignon phytopathogène Colletotrichum orbiculare. Ce champignon secrète un cocktail d’enzymes parmi lesquelles figure l’enzyme AA9A, une LPMO de la famille AA9, capable de dégrader la cellulose, un polymère complexe présente à la surface des feuilles. Un conformère de cette enzyme à l’état dimérique est représenté en « cartoon » avec un monomère en couleur mauve (à gauche) et l’autre monomère en arc-en-ciel (à droite). Le résidu de cystéine, présent dans l’appendice C-terminal désordonné et impliqué dans la formation du pont disulfure entrainant la dimérisation de l’enzyme, est montré en sphères. L’infection de la plante par la souche sauvage de C. orbiculare (wt) possédant une LPMO AA9A intacte et fonctionnelle, permet une pénétration efficace de la plante, alors que chez la souche DAA9A, où l’enzyme LPMO AA9A a été éliminée, on observe un défaut dans la formation de l’appressorium et un nombre réduit de hyphes pénétratives (flèches noires).
En savoir plus :
The disordered C-terminal tail of fungal LPMOs from phytopathogens mediates protein dimerization and impacts plant penetration. Tamburrini KC, Kodama S, Grisel S, Haon M, Nishiuchi T, Bissaro B, Kubo Y, Longhi S, Berrin JG. Proc Natl Acad Sci U S A. 2024 Mar 26;121(13):e2319998121. doi: 10.1073/pnas.2319998121. Epub 2024 Mar 21. PMID: 38513096
Contact
Laboratoires
Architecture et fonction des macromolécules biologiques - AFMB (CNRS/Aix Marseille université)
163, Avenue de Luminy, Case 932
13288 Marseille
Biodiversité et Biotechnologie Fongiques - BBF (Inrae/Aix Marseille Université)
163, Avenue de Luminy, Case 925
13288 Marseille