Un nouveau mécanisme d’hydrolyse du GTP par la tubuline
Les microtubules sont des fibres essentielles du cytosquelette dont la dynamique d’assemblage est précisément régulée dans la cellule. Cette dynamique est permise par l’hydrolyse d’une molécule de guanosine triphosphate (GTP) lors de l’assemblage de la tubuline en microtubule. Une étude structurale menée par un consortium d’équipes internationales décrypte les changements de conformation de la tubuline à l’aide d’analogues mimant les différentes étapes du cycle d’hydrolyse du GTP. Ce travail est publié dans la revue Elife.
Les microtubules sont des éléments du cytosquelette des cellules eucaryotes au sein desquelles ils participent à de nombreuses fonctions essentielles telles que le transport intracellulaire d’organites, la motilité cellulaire, ou encore la ségrégation des chromosomes lors de la mitose. Les microtubules forment des tubes creux d’environ 25 nm de diamètre et peuvent atteindre plusieurs dizaines de micromètres de longueur. Ils sont assemblés à partir d’hétérodimères de tubuline (alpha-beta) chacune des sous-unités étant associée à une molécule de guanosine triphosphate (GTP). La molécule de GTP associée à la sous-unité beta est hydrolysée en guanosine diphosphate (GDP) lors de l’assemblage, ce qui déstabilise la paroi du microtubule. Cette instabilité est nécessaire à la dynamique des microtubules dans la cellule et est précisément régulée par de nombreuses protéines intracellulaires.
Les changements de conformation de la tubuline qui accompagnent l’hydrolyse du GTP et la déstabilisation de la paroi des microtubules restent mal compris. Pour pouvoir croitre, les microtubules doivent être protégés à leur extrémité par une structure stabilisatrice. Le modèle actuel propose qu’il existe un délai entre l’assemblage de la tubuline en microtubule et l’hydrolyse du GTP, ce qui induit la formation d’une « coiffe GTP » à l’extrémité des microtubules en croissance. Des états intermédiaires d’hydrolyse existeraient, tel qu’un état « GDP-Pi » dans lequel l’hydrolyse a eu lieu, mais où le phosphate inorganique n’a pas encore été libéré du site catalytique. Cet état nucléotidique participerait également à la stabilisation des microtubules en croissance, et donc à l’architecture de la coiffe GTP.
Pour analyser les changements de conformation de la tubuline lors de son assemblage en microtubule, un consortium d’équipes internationales (Espagne, Japon, France, Suisse) a utilisé un ensemble de méthodes structurales incluant la cristallographie aux rayons X sur des cristaux de tubuline, la diffusion des rayons X aux petits angles sur des microtubules orientés par centrifugation, et la cryo-microscopie électronique de microtubules vitrifiés. Pour mener à bien ces études, ils ont utilisé plusieurs analogues nucléotidiques tels que le GDP-BeF3- (GDP lié au fluorure de béryllium, analogue de l’état GTP), et le GDP-AlF4- (GDP lié au fluorure d’aluminium, analogue de l’état GDP-Pi).
Les résultats obtenus permettent de proposer un modèle où la tubuline s’assemble sous forme de feuillets courbes ou de protofilaments individuels à l’extrémité des microtubules (Figure, région bleue). Lors du redressement des protofilaments, le site catalytique de la tubuline est activé permettant l’hydrolyse du GTP en GDP-Pi (région rouge), suivi de la libération du phosphate inorganique en solution pour produire un réseau instable de tubulines liées au GDP (région grise). La tubuline ne subit pas de changements de conformation notables lors de ces transitions, excepté au niveau du site catalytique, en opposition au modèle couramment décrit dans la littérature. Les auteurs proposent que si un changement de conformation important intervient (expansion de la tubuline), il se produirait entre les états GDP-Pi et GDP afin de permettre la libération du phosphate inorganique (doubles flèches, région orange).
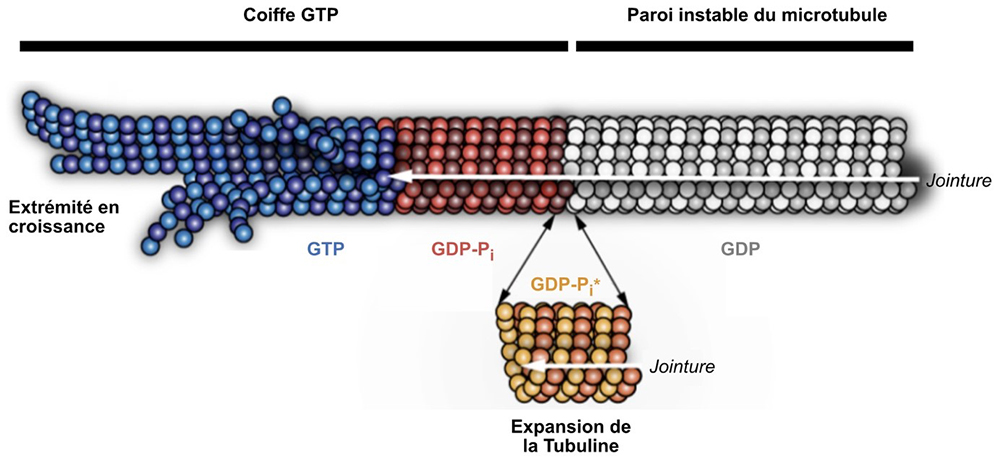
Figure : La tubuline s’assemble sous forme de feuillets courbes ou de protofilaments individuels à l’extrémité des microtubules (région bleue). Lors du redressement des protofilaments, le site catalytique de la tubuline est activé permettant l’hydrolyse du GTP en GDP-Pi (région rouge), suivi de la libération du phosphate inorganique en solution pour produire un réseau instable de tubulines liées au GDP (région grise). Un changement de conformation important (expansion de la tubuline) pourrait intervenir entre les états GDP-Pi et GDP afin de permettre la libération du phosphate inorganique (doubles flèches, région orange).
Pour en savoir plus :
Structural model for differential cap maturation at growing microtubule ends.
Estévez-Gallego J, Josa-Prado F, Ku S, Buey RM, Balaguer FA, Prota AE, Lucena-Agell D, Kamma-Lorger C, Yagi T, Iwamoto H, Duchesne L, Barasoain I, Steinmetz MO, Chrétien D, Kamimura S, Díaz JF, Oliva MA.
Elife. 2020 Mar 10;9. pii: e50155. doi: 10.7554/eLife.50155.
Contact
Laboratoire
Institut de Génétique et Développement de Rennes (IGDR) - (CNRS - Université de Rennes 1)
2 avenue du Professeur Léon Bernard, CS 34317, 35043 Rennes Cedex
