Un nouveau mécanisme de l’immunosuppression persistante chez les survivants de choc septique
Le choc septique, lorsqu'il n'est pas mortel, induit une immunosuppression persistante favorisant des infections opportunistes récurrentes. Dans cet article, publié dans la revue Immunity, les scientifiques montrent la fonction suppressive d’une population particulière de cellules B augmentée lors du sepsis, qui subit une reprogrammation métabolique, avec forte production d’ATP. L’ectonucléotidase CD39, présente à la surface de ces cellules B, hydrolyse l’ATP et génère une surproduction d’adénosine extracellulaire, ce qui induit la synthèse d’interleukine 10 (IL-10) immunosuppressive.
Le choc septique ou sepsis, lorsqu'il n'est pas mortel, induit une immunossuppression persistante qui favorise des infections opportunistes récurrentes. Des mécanismes potentiels ont été proposés, comme l’apoptose de cellules immunitaire ou l’expansion des cellules T régulatrices. Par ailleurs, le taux d’adénosine circulante est élevé après un épisode de sepsis, et l’adénosine peut induire une réponse immunosuppressive via son récepteur A2aR. Mais le lien de cause-à-effet n’était jusqu’à présent pas établi entre l’adénosine et l’immunosuppression post-sepsis.
Dans le cadre d'une collaboration avec l’Université de Sao Paulo (Brésil) au sein du Laboratoire International Associé “Lung inflammation”, les scientifiques ont utilisé le modèle murin de sepsis appelé "cecal ligation and puncture (CLP)" suivi d’une infection opportuniste pour étudier le rôle de l’adénosine dans l’immunosuppression post-sepsis. Des souris déficientes pour le récepteur de l’adénosine A2aR présentent une résistance accrue aux infections bactérienne et fongique post-sepsis, indiquant le rôle de la voie adénosine/A2aR dans la sensibilité aux infections opportunistes post-sepsis.
Dans cet article, les chercheurs apportent des éléments supplémentaires pour comprendre le mécanisme de l'immunosuppression post-sepsis médiée par l’adénosine et son récepteur A2aR. La source principale d’adénosine est l’ATP hydrolysé par l’ectonucléotidase CD39. Les résultats montrent comment une population de cellules B actives, des plasmoblastes exprimant fortement CD39 (CD39hi), est augmentée lors du sepsis et subit une reprogrammation métabolique, qui conduit à l’augmentation de la production d’ATP par ces cellules. L’ATP est ensuite converti en adénosine par le CD39 présent à la surface des plasmoblastes. L’adénosine extracellulaire générée interagit avec son récepteur A2aR présent notamment sur les cellules immunitaires de la réponse innée anti microbienne comme les macrophages et provoque l’augmentation de la production d’interleukine IL-10 immunosuppressive. Les macrophages exprimant le récepteur à l’IL-10 répondent à l’IL-10 en réduisant leur activité bactéricide, ce qui facilite les infections opportunistes.
Dans le modèle murin à la base de ces résultats, les souris déficientes en cellules B CD39hi, ne présentent pas d’élévation du taux d’adénosine après un épisode de sepsis. D’autre part, le transfert de cellules B CD39hi post-sepsis confère une résistance accrue aux infections bactériennes secondaires, démontrant le rôle de ces cellules B. Au-delà de ces données expérimentales, une augmentation de la population de cellules B CD39hi et une accumulation d’adénosine ont été observées chez des patients souffrant de choc septique.
Ces travaux révèlent la fonction suppressive des plasmoblastes CD39hi et contribuent à mieux comprendre les mécanismes de l’immunosuppression à long terme chez les survivants de choc septique.
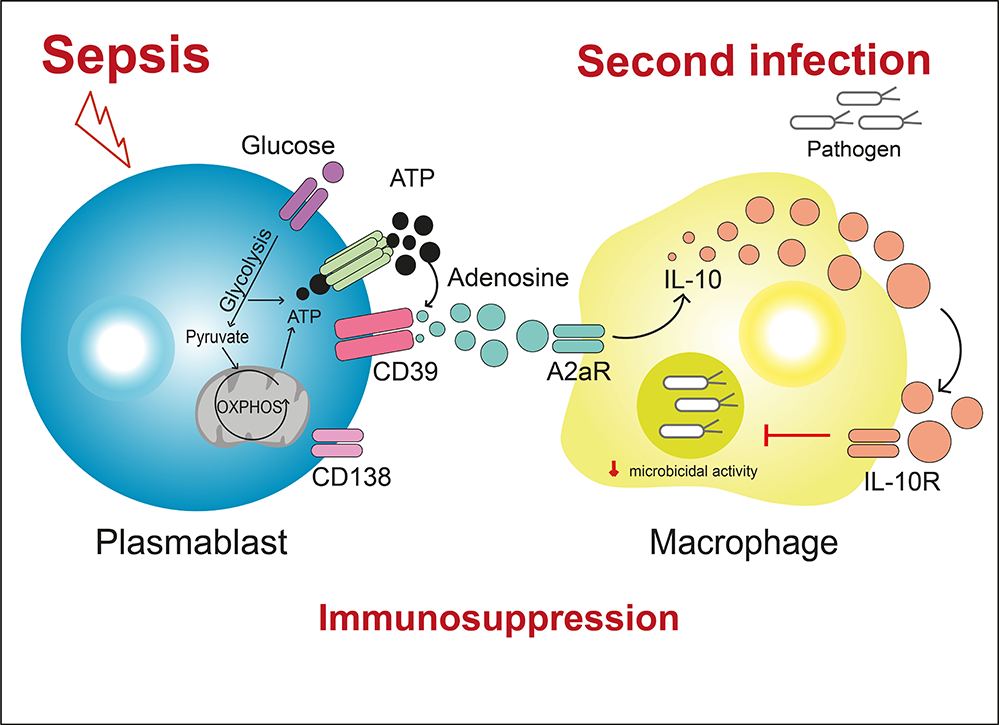
Figure : Le choc septique ou sepsis induit la production d’ATP par une population de cellules B qui expriment CD39 à leur surface. L’ectonucléotidase CD39 transforme l’ATP en adénosine, capable de se fixer sur son récepteur A2aR à la surface des macrophages, ce qui induit la synthèse d’IL-10 immunosuppressive. L’IL-10, en se liant à son récepteur IL-10R, réduit la capacité bactéricide des macrophages et contribue ainsi à l’immunosuppression post-sepsis, à l’origine d’infections opportunistes récurrentes.
Sepsis expands a CD39+ plasmablast population that promotes immunosuppression via adenosine-mediated inhibition of macrophage antimicrobial activity.
Nascimento DC, Viacava PR, Ferreira RG, Damaceno MA, Piñeros AR, Melo PH, Donate PB, Toller-Kawahisa JE, Zoppi D, Veras FP, Peres RS, Menezes-Silva L, Caetité D, Oliveira AER, Castro ÍMS, Kauffenstein G, Nakaya HI, Borges MC, Zamboni DS, Fonseca DM, Paschoal JAR, Cunha TM, Quesniaux V, Linden J, Cunha FQ, Ryffel B, Alves-Filho JC.
Immunity 2021 Aug 26. https://doi.org/10.1016/j.immuni.2021.08.005
Contact
laboratoire
Immunologie et Neurogénétique Expérimentales et Moléculaires (CNRS/Université d’Orléans)
3B rue de la Ferollerie
45071 Orleans - Cedex 2, France