Un nouveau concept d’inhibition des interactions protéine-membrane
De nombreux processus pathologiques sont orchestrés par des protéines qui s’associent à la périphérie des membranes, mais ces protéines sont le plus souvent réfractaires aux inhibiteurs classiques qui agissent en bloquant leur capacité à établir des interactions. Les chercheurs ont mis en évidence qu’une inhibition efficace et sélective de l’activité de ces protéines peut être obtenue en abordant le problème à l’envers, c’est-à-dire en stabilisant leur interaction avec la membrane dans une configuration incompatible avec l’activité biologique. Cette étude est publiée dans Nature Chemical Biology.
Les petites GTPases sont des « interrupteurs moléculaires » qui régulent une multitude de fonctions cellulaires majeures, telles que la transduction des signaux, le trafic membranaire et la motilité des cellules. Le revers de cette polyvalence est que ces protéines sont défectueuses ou détournées de leurs fonctions dans de nombreuses pathologies telles que les cancers, les infections ou les maladies cardiovasculaires. Pour fonctionner, ces protéines sont recrutées à la surface des membranes intracellulaires, où elles sont activées par des facteurs d’échange nucléotidiques (les GEF), qui sont eux-mêmes régulés par les membranes. Les petites GTPases et leurs régulateurs représentent ainsi un véritable cas d’école pour l’inhibition des interactions protéine-membrane dans un contexte à fort potentiel d’innovation thérapeutique.
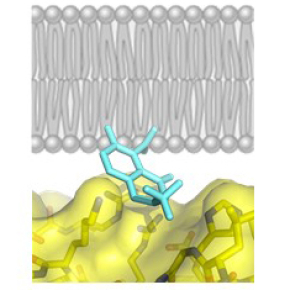
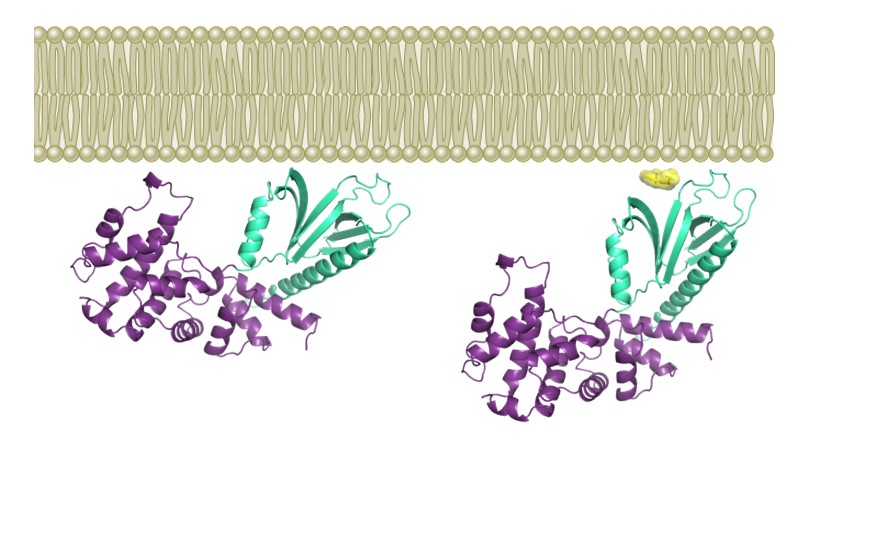
Cette étude rapporte la caractérisation d’une petite molécule, nommée Bragsin, qui exploite un mécanisme inédit pour inhiber l’activation de la petite GTPase Arf par son GEF BRAG2 à la surface des membranes in vitro et in vivo. La structure cristallographique de l’inhibiteur fixé à BRAG2, combinée à des mesures d’inhibition in vitro avec des protéines purifiées et des membranes artificielles, montre que l’inhibiteur agit en se fixant au site par lequel le GEF s’associe à la membrane. De façon remarquable, l’inhibiteur n’empêche pas la fixation du GEF à la membrane mais se glisse à l’interface entre la protéine et les lipides membranaires (Figure), ce qui perturbe l’orientation du GEF vis-à-vis de la membrane, désajuste son interaction avec la petite GTPase et empêche son activation. La molécule Bragsin inhibe l’activation d’Arf par BRAG2 in vivo, induisant la dispersion d’un compartiment cellulaire, le réseau trans-Golgien, et affectant la formation de structures pluricellulaires tridimentionnelles, les sphéroïdes tumoraux, par des cellules de cancer du sein. Bragsin, qui a fait l’objet d’un dépôt de brevet, est donc à l'avant-garde d'une nouvelle classe de molécules qui modifient les interactions protéine-membrane sans induire de dissociation.
© Jacqueline Cherfils
En savoir plus
-
PH-domain binding inhibitors of nucleotide exchange factor BRAG2 disrupt Arf GTPase signaling.
Nawrotek A, Benabdi S, Niyomchon S, Kryszke MH, Ginestier C, Cañeque T, Tepshi L, Mariani A, St.Onge RP, Giaever G, Nislow C, Charafe-Jauffret E, Rodriguez R, Zeghouf M, Cherfils J.
Nature Chemical Biology. 2019 Feb 11.DOI : 10.1038/s41589-019-0228-3