Un commutateur moléculaire active la réponse des cellules au stress réplicatif
La voie de signalisation médiée par la kinase ATR est essentielle à la survie des cellules et des organismes. Elle permet aux cellules de tolérer les obstacles à la réplication de l’ADN. Cette étude publiée dans la revue Molecular Cell lève le voile sur le mécanisme d’activation d’ATR par la protéine TopBP1. La transduction du signal de stress émerge de la condensation de TopBP1 qui forme des compartiments non-membranaires réversibles et finement régulés, au sein desquelles l’activité d’ATR est amplifiée.
Chaque cellule du corps humain subit quotidiennement des dizaines de milliers d’altérations chimiques de l’ADN. Ces lésions de l’ADN peuvent bloquer les processus de transcription en ARN et de réplication de l'ADN, induire des mutations et conduire à des aberrations chromosomiques. Au cœur de la réponse aux lésions de l’ADN, la kinase ATR signale la présence d’obstacles à la réplication de l’ADN. Cette voie de signalisation conduit à la phosphorylation de nombreuses protéines et permet à la cellule d’adapter sa physiologie à ce "stress réplicatif", notamment via l’interruption de sa progression à travers le cycle cellulaire et la mobilisation de protéines de réparation de l’ADN.
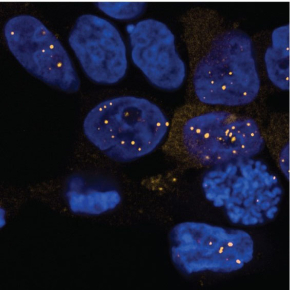
La transduction d’un signal de stress durant la réplication dépend de l’association de la kinase ATR avec une protéine activatrice nommée TopBP1 (Topoisomerase 2 – binding protein 1). Or le mécanisme d’activation de la kinase ATR par la protéine TopBP1 restait jusqu’ici mystérieuse. En général, les protéines mobilisées en réponse aux lésions de l’ADN, TopBP1 comprise, s’accumulent dans des régions distinctes du noyau pour former des foyers de la taille du micron visibles en microscopie. Mais dans quelle mesure y aurait-il un lien entre la formation des foyers nucléaires TopBP1 et le mécanisme d’activation de ATR?
Pour assurer leurs fonctions physiologiques, les protéines doivent être localisées au bon endroit et mobilisées au bon moment. Cette tâche organisationnelle immense est assurée par une multitude de compartiments. Ces derniers ne sont pas nécessairement délimités par une membrane lipidique. A l’intérieur du noyau notamment, aucun compartiment n’est délimité par une membrane. On appelle ces structures non-membranaires des condensats biomoléculaires. Les condensats concentrent protéines et acides nucléiques impliqués dans une même fonction dans un environnement physico-chimique spécifique. Ces structures résultent de l’association hautement coopératives de molécules biologiques multivalentes.
Les scientifiques ont montré que la transduction du signal de stress réplicatif médiée par ATR émerge de la formation de condensats par la protéine TopBP1. Pour en faire la démonstration, ils ont notamment fusionné TopBP1 au cytochrome 2. Ce cryptochrome impliqué dans le rythme circadien des plantes forme un tetramère après absorption de la lumière bleue. Cette astuce a permis aux chercheurs d'induire la condensation de TopBP1 en quelques minutes et en absence de lésion de l’ADN. Ils ont montré que les condensats TopBP1 agissent comme des mini réacteurs qui amplifient l’activité kinase d’ATR. Ils ont montré également que ces structures sont réversibles et que la formation des condensats TopBP1 est régulée par sa phosphorylation.
Ces observations ouvrent de nouveaux axes de recherche pour comprendre les bases structurales et moléculaires qui sous-tendent l’organisation et la régulation de la réponse des cellules aux lésions de l’ADN. Il s’agira maintenant de comprendre comment l’information permettant l’assemblage de TopBP1 est codée au niveau de sa séquence primaire proteique, et de révéler l’organisation interne des condensats TopBP1. TopBP1 étant multifonctionnelle, il est probable que d’autres fonctions émergent de l’assemblage des condensats TopBP1. Il sera aussi nécessaire de comprendre comment la composition de ces condensats est régulée au cours du cycle cellulaire.
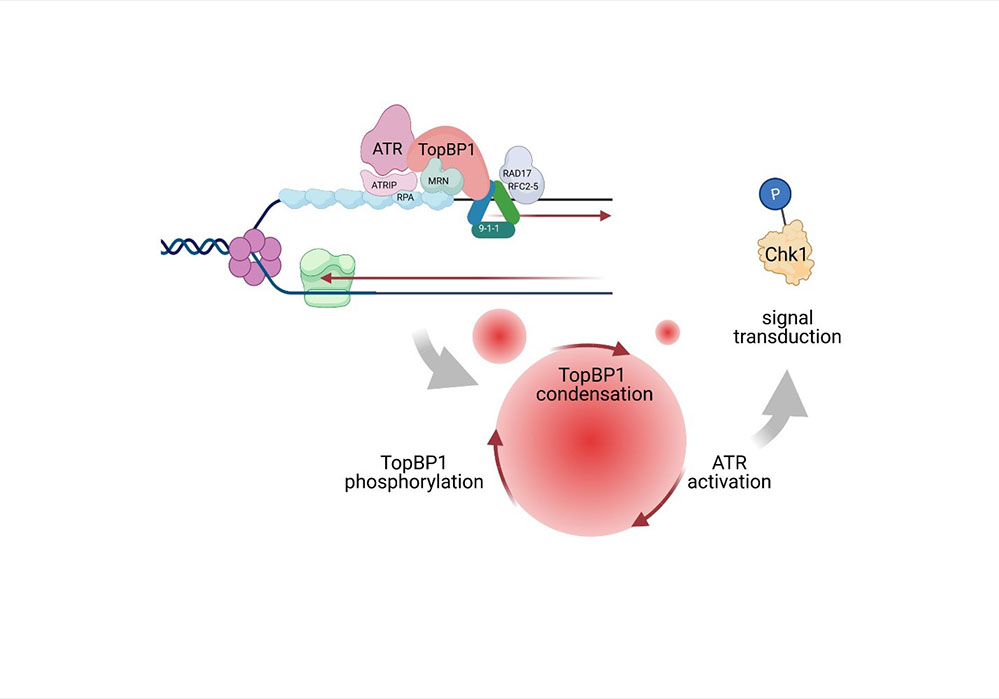
Figure : Les protéines impliquées dans la signalisation de ATR sont mobilisées au niveau des fourches de réplication bloquées. L’activité kinase basale de ATR phosphoryle TopBP1. Ceci facilite l’interaction entre molécules TopBP1 et conduit à la formation de condensats moléculaire au sein desquels l’activité kinase d’ATR est amplifiée. Cette boucle de rétroaction positive assure la transduction du signal, notamment via l’activation par phosphorylation de la kinase effectrice Chk1.
Pour en savoir plus :
Mol Cell. 2021 Mar 18;81(6):1231-1245.e8. doi: 10.1016/j.molcel.2020.12.049.
Contact
laboratoire
IGH-Institut de génétique humaine (CNRS-Université de Montpellier)
141 rue de la Cardonille
34396 MONTPELLIER CEDEX 5
France