Un bon massage du noyau pour un bon transcriptome !
Les chercheurs ont découvert la signification biologique du centrage du noyau en fin de phase de croissance ovocytaire chez la souris. En effet, le réseau d’actine qui permet le positionnement du noyau au centre de l’ovocyte de souris agite dans le même temps l’enveloppe nucléaire et la chromatine sous-jacente, régulant l’expression des gènes à ce stade. En l’absence de ce mécanisme de mécano-transduction, le stock d’ARNm maternel est altéré, compromettant le développement embryonnaire futur. Ce travail a été publié dans la revue Developmental Cell.
Dans la plupart des espèces la position excentrée du noyau ovocytaire pré-définit les axes du futur embryon puis de l’adulte. Chez l’homme et la souris, le noyau est centré en fin de croissance ovocytaire, l’ovocyte n’a pas de polarité, il n’y a donc pas de définition des axes embryonnaires par la position nucléaire. Ceci soulève la question suivante : pourquoi centrer le noyau dans ces espèces alors que l’ovocyte se divise par la suite très asymétriquement en taille, préservant ainsi ses réserves d’origine maternelle, et que des chromosomes excentrés sont nécessaires aux divisions asymétriques de cette énorme cellule ?
Lors de travaux précédents, les chercheurs avaient découvert que la diffusion active de vésicules d’actine, via le moteur moléculaire Myosine Vb, génère un gradient de pression et une force de propulsion suffisante pour faire bouger le noyau ovocytaire vers le centre. Ces forces exercées par l’actine cytoplasmique ont aussi un impact sur l’architecture nucléaire. En effet, les noyaux d’ovocytes qui ne présentent pas de réseau d’actine cytoplasmique (ovocytes mutants ou traités par des drogues affectant l’actine), dont les noyaux ont excentrés, sont déformés par rapport à ceux des ovocytes contrôles et leur chromatine (complexe structurant l'ADN via des protéines spécifiques, les histones) apparaît décondensée.
En développant une approche de biologie computationnelle, les chercheurs ont pu quantifier ces différences d’architecture nucléaire entre plusieurs catégories d’ovocytes. En l’absence de forces cytoplasmiques agissant sur le noyau, l’enveloppe nucléaire fluctue moins, étant soumise à moins de déformations. Néanmoins, une analyse en fréquence des fluctuations de l’enveloppe nucléaire, couplée à une modélisation bio-physique, suggère que les propriétés mécaniques de l’enveloppe ne sont pas altérées dans les ovocytes sans réseau d’actine cytoplasmique, mais que cette dernière est soumise à plus d’agitation en présence de la diffusion active générée par les vésicules d’actine.
Cette agitation est transmise, certes avec une dissipation d’énergie, à la chromatine qui est plus mobile quand le réseau d’actine est présent. Par un mécanisme actuellement à l’étude, la production des ARNs par le génome (transcriptome) est ainsi altérée dans les ovocytes sans réseau d’actine cytoplasmique. Ainsi le mécanisme qui assure le centrage du noyau en fin de croissance ovocytaire chez la souris module aussi l’expression des gènes à ce stade. Contrairement au dogme prévalant, quelques loci sont encore actifs en fin de croissance ovocytaire et semblent répondre à la mécano-transduction provenant des microfilaments cytoplasmiques. Ainsi le centrage du noyau en fin de croissance du follicule permet de contrôler le stock d’ARNm maternels, indispensable à la qualité du gamète femelle et à son potentiel développemental après fécondation.
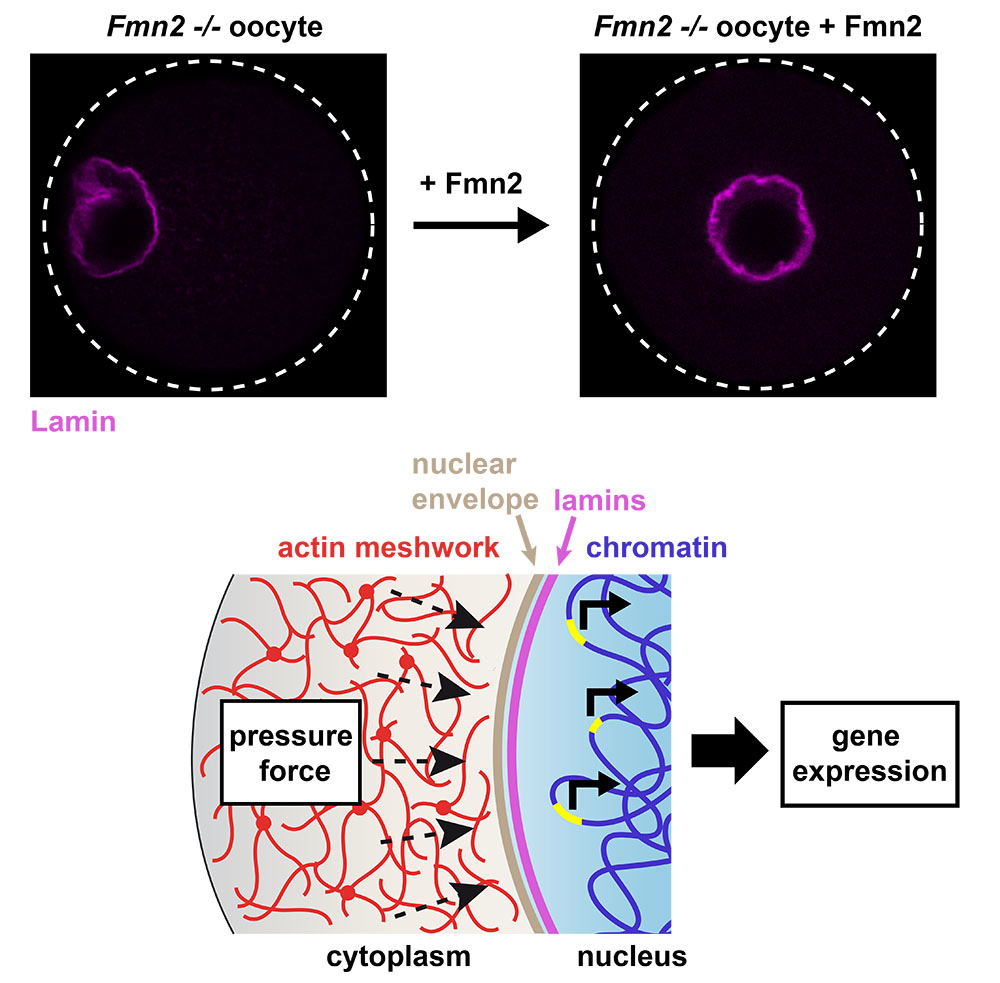
Figure : En haut : Dans l’ovocyte de souris, le centrage du noyau par l’actine cytoplasmique affecte aussi sa forme. Dans des ovocytes mutants dépourvus d’actine cytoplasmique (Fmn2 -/- , invalidés pour le nucléateur de l’actine, Formine 2) dont le noyau est excentré, la forme est altérée. Le recentrage permet au noyau de retrouver une forme régulière. En bas : Modèle de mécano-transduction. Les forces générées par le réseau d’actine lors du centrage agitent le noyau, et se transmettent à l’intérieur du noyau à travers l’enveloppe nucléaire. La chromatine est ainsi plus mobile, modulant l’expression de certains gènes.
Pour en savoir plus :
Active fluctuations of the nuclear envelope shape the transcriptional dynamics in oocytes
Almonacid M, Al Jord A, El-Hayek S, Othmani A, Coulpier F, Lemoine S, Miyamoto K, Grosse R, Klein C, Piolot T, Mailly P, Voituriez R, Genovesio A, Verlhac MH
Developmental Cell October 10, 2019 https://doi.org/10.1016/j.devcel.2019.09.010