Faire taire les éléments génétiques mobiles dans le génome
Pour en savoir plus
Dans un article publié dans Nucleic Acids Research, des scientifiques ont identifié un nouveau rôle pour la protéine Gtsf1 de paramécie dans la dégradation des petits ARN, éléments essentiels à la stabilité du génome.
Les éléments transposables, capables de se déplacer ans le génome représentent une menace pour sa stabilité. Pour limiter la mobilité des éléments transposables, les eucaryotes utilisent des petits ARN. Ces petits ARN ciblent les éléments transposables par un mécanisme basé sur l’homologie de séquence. Ils se lient aux protéines PIWI, et recrutent des enzymes modifiant les histones, et réduisant ainsi au silence les éléments transposables.
Dans cette étude, les scientifiques, dans un article publié dans la revue Nucleic Acids Research ont examiné une protéine appelée Gtsf1, déjà connue pour son rôle dans la répression des éléments transposables. Ils montrent que chez la paramécie, un organisme unicellulaire, Gtsf1 fonctionne différemment de ce qui a été observé dans d'autres organismes.
Comment les éléments transposables se distinguent-ils du reste du génome et conduisent à la production de petits ARN?
Chez les animaux, les petits ARN sont produits à partir de régions du génome riches en éléments transposables. En revanche, chez la paramécie, tout le génome produit des petits ARN, qu’ils proviennent d’éléments transposables ou non. Ensuite, un sous-ensemble des petits ARN qui correspond aux éléments transposables est sélectionné pour déclencher l’élimination des éléments transposables, une forme extrême de répression des éléments transposables.
Pour comprendre comment le tri sélectif des petits ARN s’effectue, les scientifiques ont utilisé des techniques de protéomique, de génomique et de biologie cellulaire. Ils ont découvert que la protéine Gtsf1 joue un rôle clé dans la dégradation sélective des petits ARN qui ne ciblent pas les éléments transposables. Cette dégradation implique une interaction entre Gtsf1 et la protéine PIWI, conduisant à la destruction coordonnée des ARN et de leur protéine associée.
Bien que la protéine Gtsf1 de paramécie partage des fonctions avec ses homologues dans d'autres organismes, son mode d'action est unique. Il présente des similitudes avec le mécanisme de dégradation des microARN chez les métazoaires. Ces phénomènes de dégradation des petits ARN peuvent donc avoir des points communs. Des recherches futures pourraient éclaircir les mécanismes impliqués dans ces processus et montrer qu'ils sont plus répandus et anciens évolutivement qu'on ne le pense.
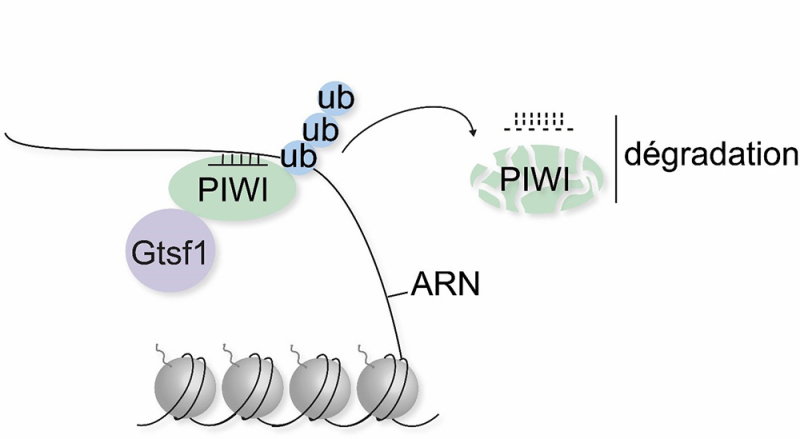
Figure : Lors du cycle sexuel de la paramécie, la protéine Gtsf1 permet la dégradation des petits ARN associés à la protéine PIWI et appariés à une molécule d’ARN par homologie de séquence. Ce processus assure le tri sélectif des petits ARN et préserve l’intégrité du génome.
En savoir plus : Olivia Charmant, Julita Gruchota, Olivier Arnaiz, Katarzyna P Nowak, Nicolas Moisan, Coralie Zangarelli, Mireille Bétermier, Anna Anielska-Mazur, Véronique Legros, Guillaume Chevreux, Jacek K Nowak, Sandra Duharcourt, The PIWI-interacting protein Gtsf1 controls the selective degradation of small RNAs in Paramecium, Nucleic Acids Research, 2024; https://doi.org/10.1093/nar/gkae1055
Pour en savoir plus
Institut Jacques Monod - IJM (CNRS/Université Paris Cité)
15 rue Helene Brion
F-75205 Paris Cedex 13, France