TP53INP1, un acteur des mécanismes de neuroprotection
Tout au long de leur vie, les neurones sont soumis à des stress cellulaires. Leur capacité à gérer ce stress est déterminante pour leur survie. Cette étude, publiée dans la revue Cell Death & Disease, apporte les premières évidences en faveur d’un rôle de la protéine induite par le stress TP53INP1 dans le maintien de l’homéostasie neuronale en condition de stress lié au vieillissement normal et à la Maladie de Parkinson (MP).
TP53INP1 est une protéine clé de réponse au stress. L’expression de son gène, TP53INP1, est fortement induite par différents stress, dont l’inflammation. TP53INP1 agit comme un double régulateur de la transcription et de l’autophagie. L’autophagie est un mécanisme essentiel pour le maintien de l’homéostasie cellulaire, permettant d’éliminer des protéines ou des organites cellulaires endommagés. La mitophagie est l’autophagie spécifique des mitochondries (les « usines à énergie » des cellules), permettant leur "contrôle qualité" par l’élimination des mitochondries défectueuses génératrices d’espèces réactives de l’oxygène dont l’excès (stress oxydatif) peut induire la mort cellulaire. La déficience de TP53INP1 a été reliée au cancer et au syndrome métabolique par des mécanismes étroitement associés, incluant inflammation, stress oxydatif et défaut de l’autophagie. Bien que ces mécanismes soient communs aux maladies neurodégénératives, le rôle de TP53INP1 dans le contexte de ces pathologies restait inexploré.
Les scientifiques partenaires de cette publication ont associé leurs expertises complémentaires dans les domaines de la MP, de la mitophagie et du stress cellulaire pour aborder cette question. L’étude s’est focalisée sur les neurones à dopamine de la substance noire (SN) dont la dégénérescence caractérise la MP et qui sont également particulièrement vulnérables au vieillissement normal, principal facteur de risque de la maladie. En raison notamment de l’architecture unique de leur arborisation axonale, très ramifiée, ces neurones présentent des besoins énergétiques élevés pour soutenir leur fonctionnement. Ainsi, leur activité et leur viabilité sont fortement dépendantes de la fonction mitochondriale et de l’efficacité des processus d’autophagie. Parmi les évidences du rôle central de l’altération de ces fonctions dans la MP, il est à souligner que PINK1 et Parkine, des protéines codées par des gènes associés à des formes familiales de la maladie, sont notamment impliquées dans une voie commune de mitophagie.
Les expériences réalisées chez la souris révèlent un effet neuroprotecteur de TP53INP1. Ainsi, l’expression de TP53INP1 est augmentée dans la SN dans un modèle de la MP basé sur la surexpression d’α-synucléine et les souris déficientes pour TP53INP1 montrent une aggravation de la perte des neurones à dopamine de la SN observée dans ce modèle de MP, ainsi que de celle associée au vieillissement normal.
Des expériences de sauvetage chez la drosophile, via la surexpression ciblée dans les neurones du gène homologue dDOR, confirment ce rôle neuroprotecteur dans une diversité de modèles, génétiques ou induit par une toxine, de la MP. Enfin, les études mécanistiques menées chez la drosophile et dans un modèle de cellule de mammifère indiquent que TP53INP1/dDOR agit comme un régulateur positif de la mitophagie basale, en promouvant l’autophagie indépendamment de la voie spécifique de mitophagie impliquant le couple PINK1 et Parkine.
Ces données suggèrent que TP53INP1 pourrait adapter les demandes d'autophagie basale pour maintenir l'homéostasie neuronale dans des conditions de stress chronique, ouvrant de nouvelles pistes pour le développement de stratégies susceptibles de ralentir l’évolution de maladies neurodégénératives.
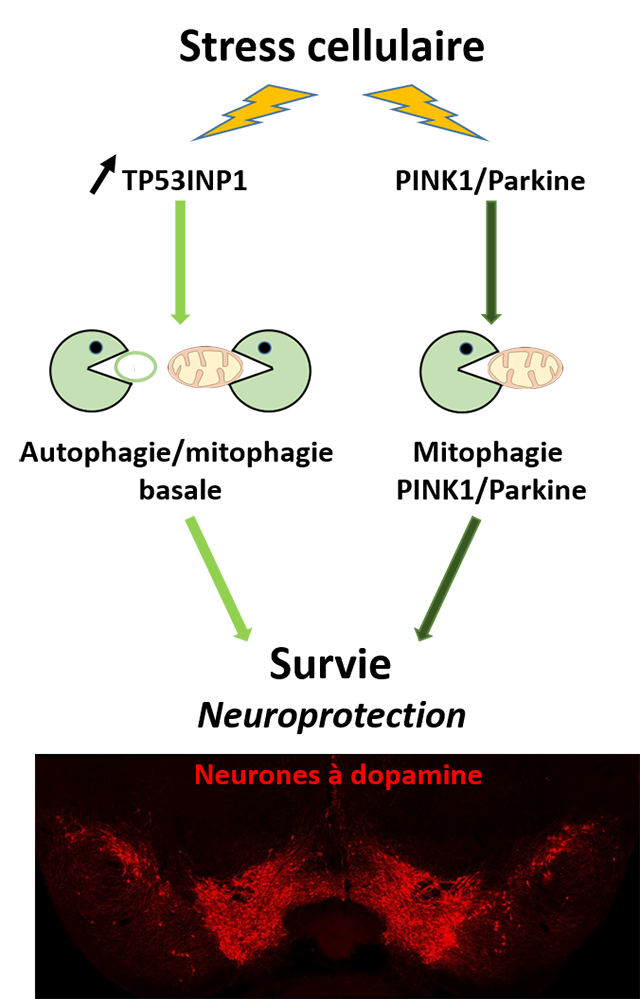
Figure : En situation de stress lié à la maladie de Parkinson, l’expression de TP53INP1 est augmentée dans la substance noire. Le recrutement de TP53INP1 dans le cytoplasme promeut l’autophagie, incluant la mitophagie. Cette voie intervient en parallèle de la voie spécifique de mitophagie dépendante de PINK1/Parkine, et contribuerait à limiter la neurodégénérescence. Ce processus de neuroprotection pourrait rendre compte du fait que la déficience de TP53INP1 accentue la perte des neurones à dopamine de la substance noire observée dans un modèle de la maladie de Parkinson chez la souris et que la surexpression de son homologue atténue les phénotypes associés à différents modèles de la maladie chez la drosophile.
Pour en savoir plus :
TP53INP1 exerts neuroprotection under ageing and Parkinson’s disease-related stress condition
Emilie Dinh, Thomas Rival, Alice Carrier, Noemi Asfogo, Olga Corti, Christophe Melon, Pascal Salin, Sylviane Lortet & Lydia Kerkerian-Le Goff
Cell Death & Disease 8 mai 2021. https://doi.org/10.1038/s41419-021-03742-4
Contact
laboratoire
Institut de biologie du développement de Marseille (CNRS/Aix-Marseille Université)
Parc Scientifique de Luminy - 13288 Marseille Cedex 9 - France