SUMO et Ubiquitine : un nouveau type de biomarqueurs dans les leucémies
SUMO et l’ubiquitine sont des petites protéines qui sont conjuguées sur des milliers d’autres protéines pour en modifier la fonction et le devenir. Grâce à l’utilisation de puces à protéines, les chercheurs ont identifié un ensemble de protéines dont les modifications par SUMO et l'ubiquitine sont différentes entre des cellules de leucémies aigues myéloides (LAM) sensibles et résistantes aux chimiothérapies. Ces travaux, publiés dans la revue Life Science Alliance, ouvrent des pistes pour le développement de nouveaux tests pour mieux prédire la réponse des patients aux chimiothérapies.
L’ubiquitine et SUMO sont des petites protéines qui sont conjuguées de façon covalente et réversible sur des milliers de protéines pour en modifier la fonction et le devenir. Ainsi, ces modificateurs post-traductionnels sont impliqués dans le contrôle de la plupart des fonctions cellulaires. Des dérégulations de leur conjugaison/déconjugaison sur leurs protéines-cibles ont été associées à de nombreuses pathologies dont des cancers.
Les chercheurs ont entrepris de déterminer si des variations de la SUMOylation, mais aussi l’ubiquitylation pourraient constituer des biomarqueurs prédictifs de la réponse aux chimiothérapies des leucémies aigues myéloides (LAM), cancers hématologiques au pronostic encore très sombre. Pour cela, ils ont utilisé des puces à protéines contenant 9000 protéines recombinantes fixées sur une lame afin d’identifier une éventuelle « signature » de SUMOylation/ubiquitylation prédictive d’une résistance aux chimiothérapies. En effet, les enzymes responsables de la conjugaison de SUMO/Ubiquitine présentes dans les extraits sont capables de modifier les protéines fixées sur la puce.
Les scientifiques ont ainsi pu identifier une signature « modifomique » d’une centaine de protéines dont le niveau de modification par SUMO ou l’ubiquitine varie significativement entre des cellules sensibles et résistantes aux chimiothérapies (Ara-C /Cytarabine ou DNR/daunorubicine) utilisées dans les LAM.
Cela a mené au développement d'un test miniaturisé, plus adapté à une pratique clinique que les puces à protéines, qui a été validé sur des prélèvements de patients. Ces travaux ont donc permis d’identifier un nouveau type de biomarqueurs protéiques et de poser les bases de tests pronostiques pour mieux prédire la réponse des patients leucémiques aux chimiothérapies et ainsi améliorer leur prise en charge thérapeutique. Deux brevets ont été déposé en 2019 par CNRS Innovation pour protéger la signature et le test miniaturisé.
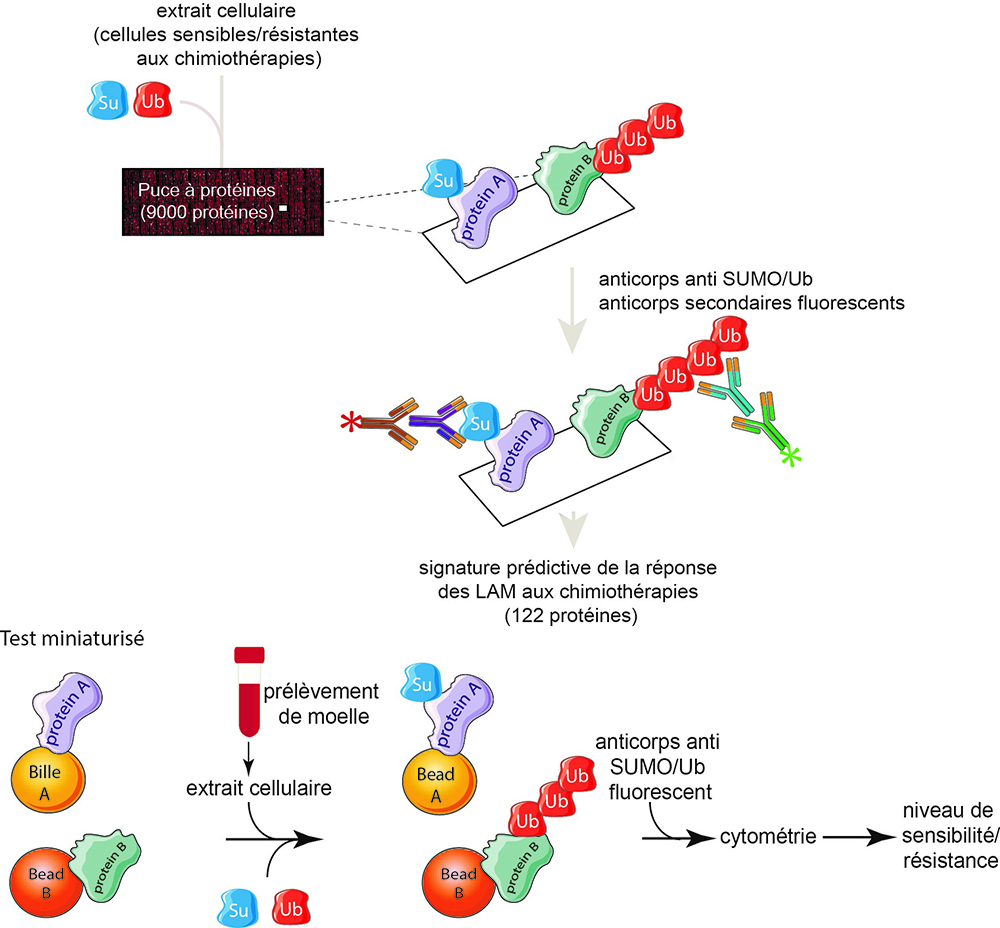
Figure : Identification des biomarqueurs de la réponse des LAM aux chimiothérapies. Des extraits de lignées de leucémies aigues myéloides (LAM), sensibles ou résistantes aux chimiothérapies, sont présentés sur des puces à protéines. Les enzymes deces extraits sont capables de conjuguer SUMO ou l’ubiquitine sur les protéines présentes sur la puce, ce qui est détecté grâce à des anticorps dirigés contre SUMO ou l’ubiquitine. L’analyse statistique des données obtenues sur les puces permet d’identifier une signature de conjugaison de SUMO/ubiquitine, prédictive de la sensibilité/résistance des LAM aux chimiothérapies. Certaines protéines de la signature sont ensuite purifiées et couplées sur des billes colorées. Ces billes, utilisées avec des extraits de cellules issues de prélèvements de moelle osseuse de patients, permettent de déterminer une probabilité de sensibilité/résistance de ces cellules aux chimiothérapies.
Pour en savoir plus:
Ubiquitin and SUMO conjugation as biomarkers of acute myeloid leukemias response to chemotherapies.
Gâtel P, Brockly F, Reynes C, Pastore M, Hicheri Y, Cartron G, Piechaczyk M, Bossis G.
Life Sci Alliance. 2020 Apr 17;3(6). pii: e201900577. doi: 10.26508/lsa.201900577.
Contact
Laboratoire
Institut de Génétique Moléculaire de Montpellier (IGMM) - (CNRS/Univ Montpellier)
1919 Route de Mende, 34293 Montpellier cedex 05