Structure atomique de SAGA et son rôle dans l’initiation de la transcription
Le co-activateur SAGA est une machine moléculaire impliquée dans l’expression des gènes et la différentiation cellulaire. Composé de 19 protéines, SAGA fait le lien entre l’organisation du génome sous forme de chromatine, les voies de signalisation cellulaires et l’initiation de la transcription prélude à la synthèse d’ARN messager. La structure atomique de SAGA obtenue par cryo microscopie électronique illumine ces différentes fonctions et explique comment SAGA interagit avec la protéine TBP et régule son activité d’initiation de la transcription. Ces résultats sont publiés dans la revue Nature.
L’expression des gènes doit continuellement être modulée pour assurer la survie, la croissance et la différentiation cellulaire. Les produits de tous les gènes ne sont pas utiles à chaque étape de la vie cellulaire et l’essentiel du génome est silencieux, empaqueté sous forme de chromatine limitant l’accès aux séquences d’ADN régulatrices placées en amont des gènes. Pour initier la transcription d’un gène particulier, ces séquences d’ADN promotrices sont reconnues par des protéines activatrices en réponse aux voies de signalisation cellulaires. Ces activateurs induisent une reprogrammation de l’organisation de la chromatine pour libérer l’information génétique et la rendre accessible à la machinerie de transcription.
Recruté par les activateurs, le complexe multiprotéique SAGA (un acronyme pour Spt-Ada-Gcn5-Acetyltransferase) modifie la chromatine grâce à deux activités enzymatiques. La sous-unité Gcn5 permet d’acétyler des résidus lysine, notamment des histones, autour desquelles s’enroule l’ADN pour former le nucléosome, l’unité de base de la chromatine. L’acétylation des histones participe à la décompaction de la chromatine. SAGA est également capable d’interagir avec la protéine TBP (pour TATA-box Binding Protein) dont le rôle est central pour la transcription de tous les gènes. En effet, la protéine TBP initie l’assemblage de la machinerie de transcription et positionne l’ARN polymérase en amont du gène à transcrire afin de synthétiser un ARN messager selon les instructions codées par l’ADN. SAGA régule l’interaction de TBP avec promoteur des gènes et empêche la transcription illégitime de séquences d’ADN non codantes. Pour mieux comprendre comment SAGA assure ses fonctions une étude structurale de SAGA en complexe avec la protéine TBP a été réalisée.
Pour étudier son organisation spatiale, SAGA a été purifié à partir d’extraits de levure. Cette première étape, cruciale pour obtenir une population homogène de molécules, est compliquée par la faible abondance de SAGA dans chaque cellule et par sa sensibilité à l’action des protéases cellulaires. Une étude préliminaire des conditions de purification a été nécessaire pour obtenir des molécules identiques de qualité irréprochable. Les chercheurs ont ensuite utilisé un cryo microscope électronique Titan pour enregistrer une image agrandie des molécules dont les dimensions n’excèdent pas 30 milliardièmes de mètre ou 30 nanomètres. La molécule est figée dans un film de glace amorphe pour préserver au mieux son architecture sous forme hydratée, mais ceci requiert que l’observation se fasse en conditions cryogéniques à une température de -176°C. Deux millions d’images moléculaires ont été enregistrées puis combinées pour construire une représentation en trois dimensions de SAGA. Après affinement de la structure, des détails aussi petits que 0.35 nanomètre ont pu être détectés et un modèle positionnant plus de 40.000 atomes de SAGA a pu être proposé (Figure).
L’organisation spatiale de SAGA nous renseigne sur ses fonctions biologiques et sur les mécanismes qui régulent l’interaction de TBP avec l’ADN. L’un des deux lobes constituant SAGA est presque entièrement occupé par la sous-unité protéique géante Tra1 formée de 3800 acides aminés organisés en répétions d’hélice-boucle-hélice appelé HEAT et comportant un domaine kinase inactif. Ce module est essentiel pour interagir avec les protéines activatrices et pour recruter SAGA en amont des gènes à transcrire. La sous-unité humaine TRRAP, homologue à Tra1, est fréquemment mutée dans certaines formes de cancer et les chercheurs ont pu cartographier ces mutations sur la structure tridimensionnelle.
Les modules enzymatiques qui permettent de modifier les nucléosomes de la chromatine sont extrêmement mobiles et rattachés au cœur de SAGA par des liens protéiques flexibles. Cette liberté de mouvement est sans doute nécessaire pour reconnaitre le substrat une fois que SAGA est lié à l’ADN. La sous-unité Taf5 joue un rôle organisateur central dans la mesure où 11 domaines protéiques contactent Taf5 qui devient ainsi un hub de connexion et de communication au sein de l’assemblage. Sept protéines de SAGA contiennent un motif protéique homologue aux histones (deux dans le cas de la sous-unité Spt3) et forment une structure similaire à l’octamère d’histones présent dans le nucléosome. La structure octamérique est toutefois déformée pour permettre à Spt3 d’interagir avec TBP dont le site d’interaction a pu être révélé pour la première fois avec des détails atomiques. Située en périphérie de SAGA, TBP est séquestrée par plusieurs sous-unités de SAGA et se trouve dans l’incapacité d’interagir avec l’ADN qui ne peut s’approcher suffisamment près de TBP. Cette inhibition régule l’accès de TBP aux séquences promotrices des gènes et n’est levée qu’en présence d’une autre protéine appelée TFIIA.
La structure de SAGA explique de nombreuses observations génétiques sur le rôle de ses sous-unités et établi un nouveau paradigme pour la régulation de la fonction de TBP.
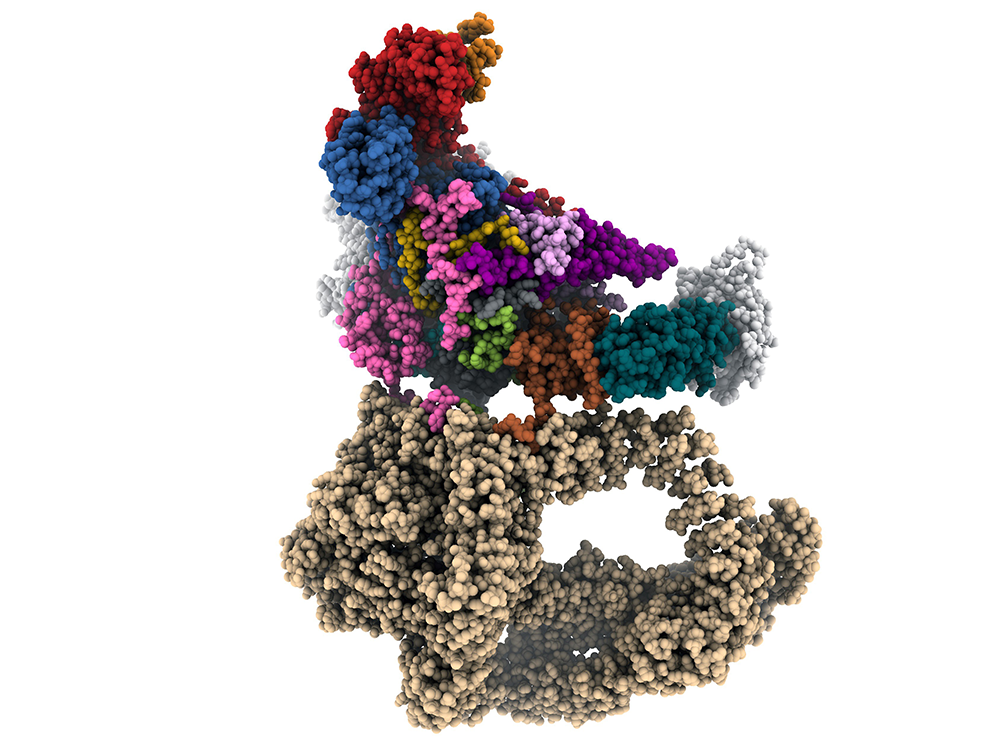
Figure : Structure atomique du co-activateur transcriptionnel SAGA déterminée par cryo-microscopie électronique. La sous-unité Tra1 est représentée en beige et TBP en vert sombre.
Pour en savoir plus:
Structure of SAGA and mechanism of TBP deposition on gene promoters.
Papai G, Frechard A, Kolesnikova O, Crucifix C, Schultz P, Ben-Shem A.
Nature. 2020 Jan;577(7792):711-716. doi: 10.1038/s41586-020-1944-2. Epub 2020 Jan 22
Laboratoire :
Institut de génétique et de biologie moléculaire et cellulaire-IGBM (CNRS / Inserm / Université de Strasbourg)
1, rue Laurent Fries
67404 Illkirch
Vidéo
© Gabor Papai
Structure atomique du co-activateur transcriptionnel SAGA déterminée par cryo-microscopie électronique. La sous-unité Tra1 est représentée en beige et TBP en vert sombre.