Sous le regard des scientifiques, les virus deviennent des muses de l’innovation thérapeutique
Une nouvelle étude publiée dans PNAS décrit les virus comme des modulateurs des fonctions des cellules humaines. Les interfaces d’interaction des protéines virales avec les protéines humaines sont utilisées comme matrices pour dessiner des molécules chimiques originales, offrant de nouvelles perspectives dans de multiples aires thérapeutiques. En utilisant cette approche, les scientifiques ont identifié une nouvelle molécule qui présente une activité prometteuse contre la stéatose hépatique non alcoolique.
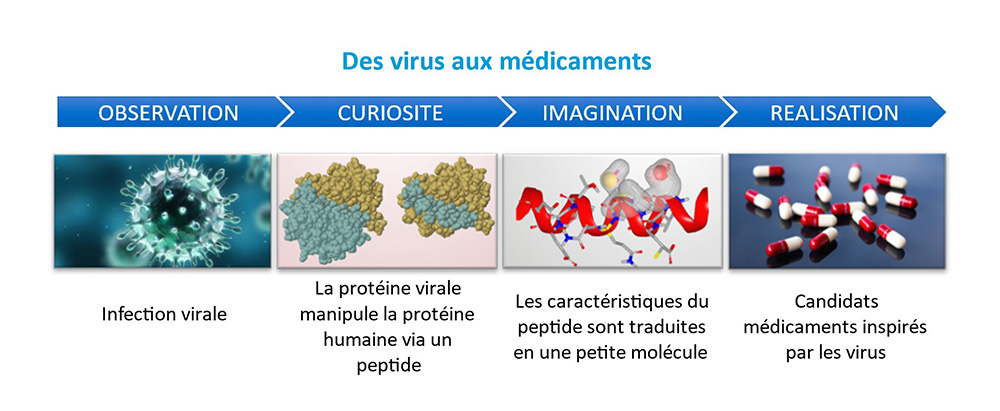
Dans une étude publiée dans PNAS, des scientifiques présentent une nouvelle voie pour innover en matière de médicaments qui consiste à utiliser les virus comme source d’inspiration. Cette approche biomimétique dans la production de nouvelles options thérapeutiques s’appuie sur la capacité des virus à détourner les fonctions cellulaires pour permettre leur réplication acquise au cours de leur longue coévolution avec leurs hôtes. Dans la cellule, les fonctions sont supportées par un réseau d’interactions protéiques. Pendant l’infection, le virus interagit avec ce réseau via ses propres protéines et module ainsi finement une grande diversité de fonctions cellulaires. L’interaction entre la protéine humaine et la protéine virale peut se faire au travers de surfaces très variables.
Les virus peuvent être considérés comme des pionniers en matière de « drug discovery »
Dans cette étude, les scientifiques ont porté leur attention sur les surfaces les plus petites appelées peptides (composés de 5 à 20 acides aminés, constituants de base des protéines). Ces peptides peuvent être synthétisés en fusion avec une séquence de pénétration cellulaire et atteindre leur cible protéique dans la cellule hôte. Ainsi, une simple information d’interaction entre une protéine virale et une protéine humaine (HV-PPI) permet à la fois d’identifier une protéine humaine manipulable et de dériver une nouvelle entité (peptide) pouvant moduler une fonction associée à cette protéine humaine. De ce point de vue, les virus peuvent être considérés comme des pionniers en matière d’innovation thérapeutique ou « drug discovery ».
Plus de 800 avatars de ce que seront les futurs médicaments
La littérature regorge d’HV-PPI que les auteurs sont allés récolter selon un processus de curation méticuleux, en annotant précisément les domaines d’interaction. Ces données sont aujourd’hui accessibles dans la base Vinland (Viral Infection Landscape, https://vinland.network), qui offre à la communauté scientifique un paysage de l’infection virale composé de 100,000 HV-PPI. Cette base répertorie aujourd’hui plus de 800 peptides d’origine virale qui ciblent en majorité des protéines humaines qui n’ont jamais été abordées par l’industrie pharmaceutique. Ces peptides peuvent être considérés comme des avatars de ce que seront les futurs médicaments. En effet, comme la plupart des médicaments, les peptides n’empêchent pas l’expression de leur cible protéique humaine mais plus vraisemblablement bloquent l’interaction entre leur cible avec une autre protéine humaine. Une librairie pilote constituée d’une centaine de peptides a été criblée pour interférer avec la réplication de pathogènes d’intérêt thérapeutique (virus de l’hépatite C, VIH, grippe, virus Epstein Barr et Francisella Novicida). Ces cribles ont permis d’identifier de nouveaux agents modulateurs de la réplication de ces pathogènes ainsi que de nouvelles cibles documentées.
La meilleure molécule trouvée aussi active que le traitement de référence
L’étude s’est ensuite orientée sur un peptide extrait d’une protéine d’un virus de l’herpès, non toxique et très actif contre la grippe. Il interagit avec une famille de protéines localisées à la mitochondrie, appelées protéines NEET, qui interviennent notamment dans le métabolisme cellulaire et l’homéostasie du fer. Alors que les peptides sont de très bons outils de laboratoire, de nombreux obstacles entravent leur développement jusqu’à la clinique. Pour contourner ces obstacles, les pharmacophores des peptides, déterminants essentiels à l’interaction avec leur cible, sont mimés par des petites molécules chimiques selon une approche de conception de substances pharmacologiquement actives ou « drug design » assistée par ordinateur. Les molécules identifiées ont été elles aussi criblées sur la réplication du virus de la grippe. Après optimisation, la meilleure molécule est trouvée aussi active que le traitement de référence. La connaissance des cibles de cette molécule permet de repositionner son indication vers une aire thérapeutique plus appropriée : la stéatose hépatique non alcoolique ou foie gras non alcoolique. Ainsi, chez les souris malades, cette molécule améliore de façon spectaculaire les paramètres hépatiques et rénaux de ces dernières.
Cette approche révolutionnaire peut se décliner très largement sur la grande diversité des couples peptides-cibles et donc adresser des protéines humaines considérées jusque-là comme impossibles à cibler par l’industrie pharmaceutique. Au-delà des cibles, les aires thérapeutiques sont vastes à partir du moment où la pathologie peut être traitée en ciblant une protéine humaine intracellulaire.
En savoir plus :
Meyniel-Schicklin L, Amaudrut J, Mallinjoud P, et al. Viruses traverse the human proteome through peptide interfaces that can be biomimetically leveraged for drug discovery. Proc Natl Acad Sci U S A. 2024;121(5):e2308776121. doi:10.1073/pnas.2308776121
Contact
Laboratoire
Enyo Pharma
Bioserra 1, 60 avenue Rockefeller
Batiment B
69008 Lyon
