Rôle clé de l’Annexine A1 dans la réparation tissulaire
Les macrophages jouent un rôle crucial dans la réparation tissulaire. Dans cet article publié dans la revue Journal of Clinical Investigation, les chercheurs identifient la protéine Annexine A1 comme un activateur direct de la résolution de l’inflammation par les macrophages, indispensables à la réparation tissulaire.
Le muscle strié squelettique est un tissu contractile principalement composé de fibres musculaires multinucléées. C’est un excellent modèle d’étude de la réparation tissulaire car il est capable de se régénérer complètement grâce aux propriétés des cellules satellites, les cellules souches musculaires localisées à la périphérie des fibres musculaires. Après une lésion, ces cellules sont activées, elles prolifèrent, se différencient puis fusionnent pour reformer de nouvelles fibres. Parallèlement, les cellules du système immunitaire, parmi lesquelles les neutrophiles et les monocytes, infiltrent le tissu endommagé. Ces derniers se différencient en macrophages pro-inflammatoires qui sont capables de phagocyter les fibres musculaires endommagées et de favoriser la prolifération des cellules satellites. Ils changent ensuite de phénotype pour devenir des macrophages anti-inflammatoires stimulant la fusion des cellules myogéniques, favorisant ainsi la formation des nouvelles fibres musculaires et la régénération du tissu musculaire. Ce changement phénotypique, contrôlé en partie par la protéine AMPK, est un événement crucial du processus de régénération et son altération est associée à des pathologies telles que les myopathies dégénératives.
Afin de comprendre comment la protéine AMPK est activée dans les macrophages, les chercheurs se sont intéressés à la protéine Annexine A1, une protéine secrétée déjà connue pour son rôle dans la résolution de l’inflammation. En utilisant un modèle de lésion du muscle Tibialis Anterior induite chez la souris par une injection de cardiotoxine (une toxine du venin de serpent), ils ont montré que l’Annexine A1 est principalement exprimée par les neutrophiles et les macrophages au cours de la régénération musculaire. L’inactivation chez la souris du gène de la protéine Annexine A1, ou du gène Fpr2 qui code pour son récepteur, induit une altération de la régénération musculaire suite à une blessure. Ces résultats sont également observés chez des souris où le gène AnxA1 est inactivé seulement dans les cellules myéloïdes, confirmant son rôle spécifiquement dans ce type cellulaire. Ce défaut de régénération musculaire est associé à une réduction du changement phénotypique des macrophages vers le phénotype permettant la réparation tissulaire.
Afin de caractériser le mécanisme par lequel l’Annexine A1 régule le changement phénotypique des macrophages, des modèles de différenciation in vitro de macrophages dérivés de moelle osseuse murine ou de sang humain ont été utilisés. Cela a permis de montrer que l’Annexine A1 promeut l’acquisition du phénotype anti-inflammatoire par les macrophages via sa fixation sur le récepteur Fpr2 et la phosphorylation de la protéine AMPK. En effet, des macrophages dans lesquels le gène codant pour le récepteur Fpr2 (ou pour la sous-unité α1 de l’AMPK) a été inactivé ne sont plus sensibles à l’action de l’Annexine A1.
Collectivement, ces résultats identifient l’axe ANXA1/FPR2/AMPK comme une voie de signalisation cruciale de la résolution de l’inflammation par les macrophages permettant la réparation tissulaire, et ouvrent de nouvelles perspectives dans le traitement de pathologies associées à une inflammation chronique.
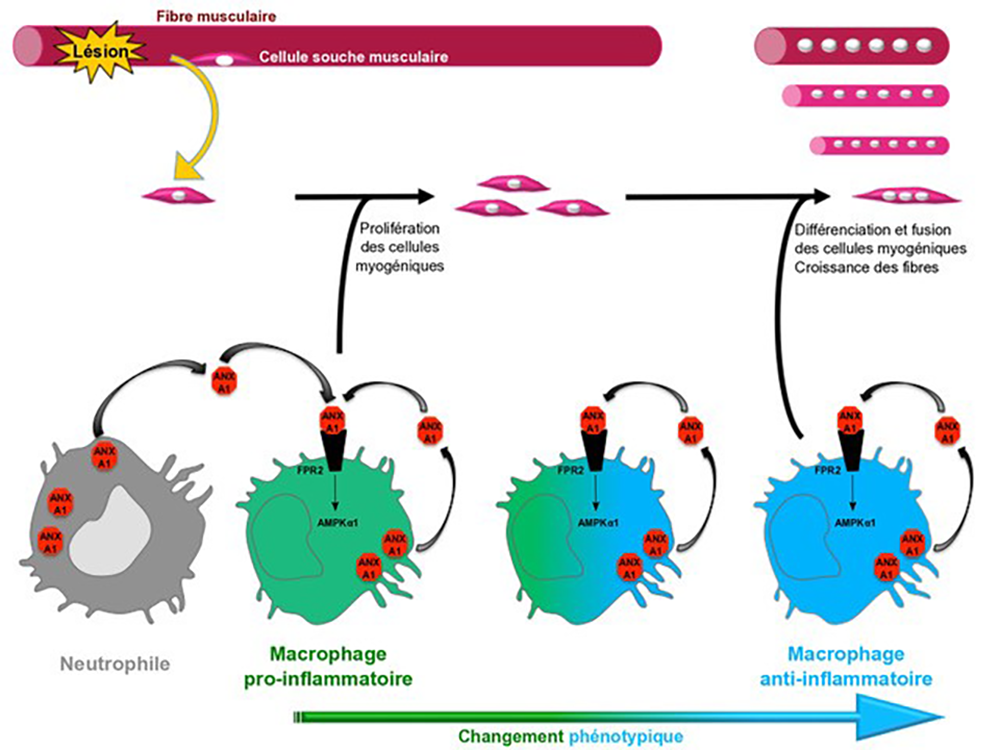
Figure : Après une lésion musculaire et l’activation des cellules satellites (les cellules souches musculaires), le tissu endommagé est infiltré par des neutrophiles et des monocytes sanguins. Ces derniers se différencient en macrophages pro-inflammatoires favorisant la prolifération des cellules satellites. L’Annexine A1, produite à la fois par les neutrophiles et les macrophages pro-inflammatoires, se fixe sur le récepteur Fpr2 présent sur les macrophages pro-inflammatoires et induit la phosphorylation de la protéine AMPK. Cette activation de l’AMPK promeut l’acquisition du phénotype anti-inflammatoire par les macrophages, ce qui est crucial pour stimuler la fusion des cellules myogéniques et la formation des nouvelles fibres musculaires.
Pour en savoir plus :
Annexin A1 drives macrophage skewing to accelerate muscle regeneration through AMPK activation.
McArthur S, Juban G, Gobbetti T, Desgeorges T, Theret M, Gondin J, Toller-Kawahisa JE, Reutelingsperger CP, Chazaud B, Perretti M, Mounier R.
J Clin Invest. 2020 Feb 4. pii: 124635. doi: 10.1172/JCI124635. [Epub ahead of print]
Contact
Laboratoires
Institut NeuroMyoGène (CNRS / INSERM / UCB Lyon1)
8 avenue Rockefeller
69008 Lyon