Résistance aux antibiotiques : une nouvelle cible dans la paroi bactérienne
Les antibiotiques telle que la pénicilline, sont utilisés comme traitement anti-infectieux depuis presque un siècle. Cependant, les phénomènes de résistance développés par plusieurs pathogènes soulignent l’importance d’une recherche visant à identifier de nouvelles cibles potentielles. L’équipe d’Andréa Dessen à l’Institut de biologie structurale, en collaboration avec les équipes d’Ivo Gomperts-Boneca à l’Institut Pasteur et le Brazilian Biosciences National Laboratory, a caractérisé un complexe entre PBP2 et MreC, deux protéines essentielles pour l’élongation de la paroi bactérienne. Ces résultats, publiés le 3 octobre 2017 dans la revue Nature Communications, ouvrent la voie au développement de nouveaux antibiotiques ciblant la région d’interaction entre les deux protéines.
Depuis leur introduction sur le marché international dans les années 40, les antibiotiques de type beta-lactamine, comme les pénicillines et céphalosporines, sont le traitement de choix pour des infections qui vont de la pneumonie jusqu’à la peste. Les beta-lactamines perturbent la machinerie de formation de la paroi cellulaire en bloquant l’activité des Penicillin-Binding Proteins (PBPs), protéines qui catalysent les dernières étapes de la synthèse d’un de ses composants essentiels. Ce composant, intitulé ‘peptidoglycane’, forme une structure qui ressemble à un « filet de pêcheur » qui entoure toute la bactérie. Ce « filet » est essentiel non seulement pour sa stabilité mais aussi pour le bon déroulement des différentes étapes du cycle cellulaire, comme la division et l’élongation de la paroi du microorganisme. Ceci explique pourquoi plusieurs PBPs sont indispensables pour la survie bactérienne.
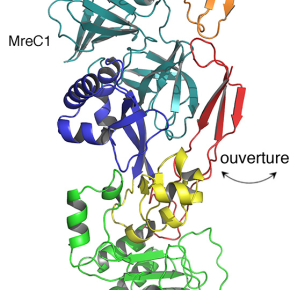
Outre leur fonction enzymatique, les PBPs sont engagées dans des interactions essentielles avec d’autres protéines qui participent à la formation de la paroi. L’une d’entre elles, MreC, est considérée comme une plateforme permettant la stabilisation d’autres protéines qui participent au même processus. Un complexe entre une PBP et MreC représenterait donc le « cœur » de l’elongasome, structure clé pour la survie bactérienne qui pourrait être ciblée pour le développement de nouveaux agents antibactériens. Cependant, ces complexes ont toujours été considérés comme instables et fragiles, et leur étude structurale, très difficile.
Les chercheurs ont caractérisé, pour la première fois, le complexe PBP2:MreC du pathogène humain Helicobacter pylori. Cette structure cristalline, obtenue a une résolution atomique grâce à la collecte de données au synchrotron ESRF à Grenoble, a révélé que pour que les deux protéines interagissent, l’une d’elle (PBP2) doit s’ouvrir, pour permettre la formation d’une structure qui ressemble à une fermeture éclair avec sa partenaire MreC. Cette structure doit rester fermée pour que les deux partenaires puissent rester associés. Toute atteinte à l’ouverture de cette structure, par exemple par l’introduction de mutations, empêche non seulement la reconnaissance entre PBP2 et MreC mais aussi la bonne formation de la paroi lors de l’élongation des cellules filles, générant ainsi des cellules de diamètre aberrant qui éventuellement meurent. La superficie d'interaction entre les deux protéines pourrait être une cible potentielle pour le développement d'inhibiteurs totalement novateurs.
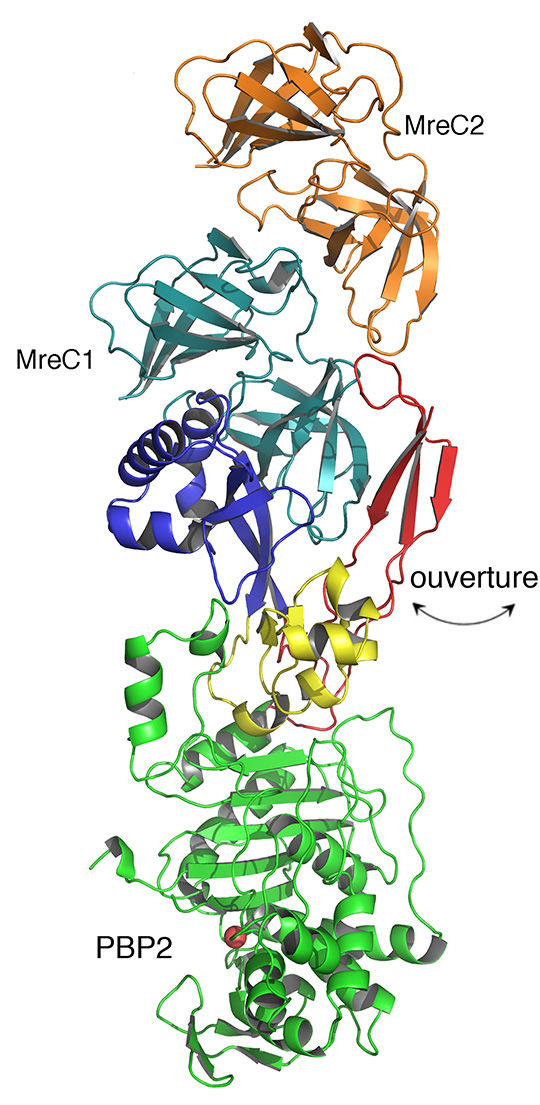
© Andréa Dessen
En savoir plus
-
Molecular architecture of the PBP2:MreC core bacterial cell wall synthesis complex.
Contreras-Martel C, Martins A, Ecobichon C, Maragno Trindade D, Mattei PJ, El Ghachi M, Hicham S, Hardouin P, Boneca IG, Dessen A.
Nature Communications 8, Article number: 776(2017doi:10.1038/s41467-017-00783-2